* مطالب علمی *
ایساتیس
آقاشیر
.: شهر عشق :.
جملات زیبا
تعقل و تفکر
دکتر رحمت سخنی
بیگانه ، دختری در میان مردمان
تا ریشه هست، جوانه باید زد...
اس ام اس عاشقانه
خاطرات خاشعات
اس ام اس سرکاری اس ام اس خنده دار و اس ام اس طنز
وسوسه عقل
پرهیزکار عاشق است !
فروش و تعمیر موبایل در استان یزد
آموزش
وبلاگ تخصصی کامپیوتر
هک و ترفند
فروش و تعمیر موبایل در استان یزد
انجمن فیزیک پژوهش سرای بشرویه
عاشقان خدا فراری و گریزان به سوی عشق و حق®
وبلاگ عشق و محبت ( اقا افشین)
باید زیست
دست نوشته های دو میوه خوشمزه
در دل نهفته ها
روزگاران(حتما یه سری بهش بزن ضرر نمی کنی)
فقط برای ادد لیستم...سند تو ال
تجربه های مدیریت
سولات تخصصی امتحان دکترا دانشگاه آزاد
سولات تخصصی امتحان دکترا دانشگاه آزاد
ارزانترین و بزرگترین مرکز سوالات آزمون دکترا
عکس و اس ام اس عشقولانه
دانلود نرم افزار های روز دنیا
شاهرخ
مکانیک هوافضا اخترفیزیک
مکانیک ، هوافضا ،اخترفیزیک
وبلاگ تخصصی فیزیک و اختر فیزیک
وبلاگ تخصصی فیزیک جامدات
همه با هم برای از بین نرفتن فرهنگ ایرانی
انتخاب
فیزیک و واقعیت
ترجمه متون کوتاه انگلیسی
دنیای بیکران فیزیک
مقدمه
 |
ساختار سیاهچالهها
سیاهچالهها چگونه بوجود میآیند؟
همچنین باید بدانیم که وقتی نوترونها در هم شکستند، دیگر هیچ چیز مطلقا وجود ندارد که از در هم پاشیدن ستاره جلوگیری کند. اگر شما خود را روی سطح یک توده در حال از هم پاشیدن تصور کنید، آنگاه شما با فرو ریختن آن جسم به مرکز آن نزدیکتر و نزدیکتر خواهید شد. و بنابراین نیروی جاذبه بیشتر و بیشتری را حس خواهید کرد. تا هنگامی که ستاره به مرحله کوتوله سفید برسد، شما بیش از 1.016 تن وزن پیدا خواهید کرد.
 |
وقتی که ستاره به در هم پاشیدن ادامه داد و از مرحله ستاره نوترونی هم گذشت و بطور کامل از هم پاشید، وزن شما از 15000 میلیون تن بیشتر و بیشتر خواهد شد. اگر سیاهچاله به اندازه کافی به ما نزدیک بود، میتوانستیم نیروی جاذبه بر آن را حس کنیم. اما وقتی یک سیاه چاله در میان ستارهها خیلی دورتر از ما قرار دارد، آیا میتوانیم وجود آنرا اثبات کنیم؟ برای این منظور اخترشناسان دو راه آشکار شدن حدس میزنند.
- اول از روی جرم سحابی برای مثال اگر آنها جرمهای تمام ستارگان موجود در یک خوشه ستارهای مرئی بطور قابل ملاحظهای کمتر از جرم خوشه وجود داشته باشد، مرکز کهکشانها به عنوان مکانهایی تلقی میشوند که در آنها سیاهچالهها وجود دارند. زیرا چگالی مواد در آنجا زیاد است.
- راه دوم نیز این بوده که اگر چه hc سیاهچالهها هیچ تشعشعی خارج نمیشود، اما چیزهایی که در سیاهچالهها سقوط میکنند. به هنگام سقوط اشعه ایکس از خود منتشر میکنند و هر چیز کوچکی که در سیاهچالهها سقوط کند تنها مقدار کمی اشعه ایکس از خود منتشر میکند. این مقدار برای کشف آن در فاصله میلیونها میلیون کیلومتری کافی نخواهد بود.
در سال 1971 یک دانشمند انگلیسی به نام استفن هاوکینگ عنوان کرد که این واقعه بوجود آمدن سیاهچالهها هنگامی که جهان نخستین انفجار بزرگ خود را آغاز کرد اتفاق افتاده است. هنگامی که تمامی مواد تشکیل دهنده جهان منفجر شد، مقداری از این مواد آن چنان به هم فشرده شدند که تبدیل به سیاهچاله گشتند. وزن برخی از این سیاهچالهها ممکن است به اندازه وزن یک سیاره کوچک و یا از آن کمتر باشد و وی آنها را سیاهچاله کوچک نامید.
نتایج تحقیقات هاوکینگ
-
سیاهچالهها میتوانند وزن از دست بدهند.
-
مقداری از انرژی جاذبهای آنها در خارج از محدوده شعاع شوارتز شیلد ستاره به ذرات ماده تبدیل میشود.
-
ممکن است این ذرات به فضای بیرون بگریزند از این طریق مقداری از مواد تشکیل دهنده سیاهچالههای بزرگ که به اندازه یک ستاره وزن دارند، برای تبخیر همه مواد تشکیل دهندهاش میلیونها میلیون سال وقت لازم است. در حالی که در این مدت خیلی بیشتر از این مقدار ماده به آن اضافه میشود. بنابراین هیچگاه از طریق تبخیر وزن آن کاسته نمیشود.
-
هر چه سیاهچاله کوچکتر باشد سرعت تبخیر آن بیشتر است یک سیاهچاله کوچک واقعی باید بیشتر از مقدار مادهای که به خود جذب میکند وزن از دست بدهد. بنابراین سیاهچاله کوچک باید بوسیله تبخیر کوچکتر و کوچکتر شود و بالاخره هنگامی که دیگر خیلی خیلی کوچک شد یک مرتبه تبخیر آن حالت انفجاری به خود گرفته و تشعشعاتی حتی با انرژی بیشتر از اشعه ایکس منتشر کند. اشعه منتشر شده از این طریق اشعه گاما خواهد بود.
-
سیاهچالههای کوچکی که 15 میلیون سال پیش هنگام نخستین انفجار بزرگ جهان ایجاد شدهاند، اکنون ممکن است در حال ناپدید شدن باشند. هاوکینگ اندازه اولیه آنها و نوع اشعه گامایی را که هنگام انفجار تولید میکنند، حساب کرد.
 |
انواع سیاهچاله
-
شوارتس شیلد: ساده ترین نوع سیاهچالههاست، بار و چرخش ندارد، تنها یک افق رویداد و یک فوتون کره دارد، از آن نمی توان انرژی استخراج کرد. شامل تکینگی ، نقطهای است که در آن ماده تا چگالی نامحدود در هم فرو رفته است.
-
رایزنر- نورد شتروم: هم بار دارد وهم چرخش ، می تواند دو افق رویداد داشته باشد ، اما تنها یک فوتون کره دارد. شامل یک تکینگی نقطه ای است که وجود آن در طبیعت نامحتمل است، زیرا بارهای آن همدیگر را خنثی می کنند.
-
کر: چرخش دارد، اما بار ندارد. بیضی و از بیرونی حد استاتیک است. منطقه تیره میان افق رویداد و حد استاتیک ارگوسفر است، که می توان از آن انرژی استخراج کرد. می تواند دو افق رویداد و دو حد استاتیک داشته باشد. دو فوتون کره دارد. شامل یک تکینگی حلقهای است.
-
کر- نیومان: هم بار دارد و هم چرخش ، همان سیاهچاله کر است، جز اینکه بار دارد، ساختارش شبیه ساختار سیاهچاله کر است. میتوان از آن انرژی استخراج کرد. یک تکنیگی حلقهای دارد.
به نظر پژوهشگران چهارنوع سیاهچاله همچنانکه ذکر شد می تواند وجود داشته باشند. مهمترین موضوع در باب سیاه چاله آنست که ، بدانیم ماده در داخل سیاهچالهای که حاصل آمده است در نهایت به چه سرنوشتی دچار می شود؟ اختر فیزیکدانان میگویند:
اگر مقداری ماده به داخل حفره سیاه از قبیل آنچه که از یک ستاره وزین مرده بجای مانده بیندازید، نتیجه نهایی همواره الزاما یک چیز خواهد بود و تنها جرم ، بار الکتریکی و اندازه حرکت زاویه ای که جسم با خود حمل می کند باقی خواهند ماند. اما اگر کل جهان به داخل حفره سیاه خود بیفتد، یعنی به شکل سیاهچاله در آید، دیگر حتی کمیاب بنیادی (جرم) ، بار الکتریکی و اندازه حرکت زاویه ای نیز ناپدید می گردند.
مجهولات سیاهچالهها
اگر ستاره شناسان بتوانند نوع پرتوهایی که هاوکینگ پیش بینی کرده است، شناسایی کنند، مدرک خوبی برای تأیید تشکیل و وجود سیاهچاله بدست خواهد آمد. اما تاکنون پرتوهای پیش بینی شده کشف نشدهاند. با اینحال هر لحظه ممکن است این پرتوها شناسایی شوند. دلیل تابش اشعه ایکس از حفره سیاه این است که جرمی که توسط طوفانهای ستارهای خود ستاره ، از سطح آن میگریزند، در فاصله مناسبی که به حفره سیاه رسیدند، توسط حفره شکار میشوند و در مداری به دور حفره شروع به چرخش کرده و به این ترتیب شکل یک دیسک عظیم را تشکیل میدهند.
با توجه به این نکته که لایههای داخلیتر دیسک سریعتر از لایههای خارجی میچرخند، در اثر اصطکاک لایههای مختلف دیسک گرم شده و شروع به تابش اشعه ایکس میکنند. به این دیسک ، دیسک تجمعی گفته میشود. این حالت برای اولین بار در ستاره دوتایی (دجاجه1-X) مشاهده شده است. احتمالا قطر خود حفره سیاه (قطر افق حادثه) 30 کیلومتر است و برای تمامی ستاره دوتایی سیاهچاله ساختمان به همین شکل است.
کلمات کلیدی: اختر فیزیک، هواشناسی و اختر فیزیک
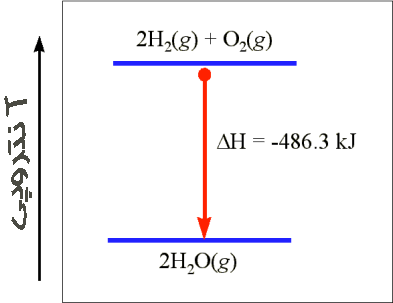
| تغییرات آنتالپی مربوط به تراکم یونهای گازی شکل مثبت و منفی به یک بلور را انرژی شبکه آن بلور مینامند. برای مثال انرژی شبکه کلرید سدیم 788- کیلو ژول بر مول است. |
  |
علامت انرژی شبکه
از آنجا که در اینگونه فرآیندها همواره انرژی آزاد میشود، تمام انرژیهای شبکه علامت منفی دارند. برعکس انرژی مورد نیاز برای جدا کردن یونهای یک مول بلور برابر انرژی شبکه با علامت مثبت است. 
اهمیت انرژی شبکه با استفاده از تحلیل "بور - هابر"
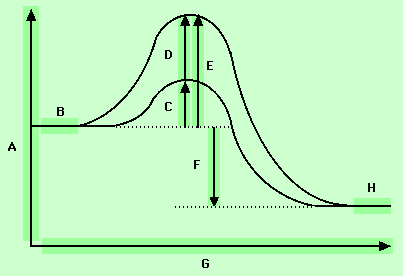
اهمیت انرژی شبکه را با استفاده از روش تحلیلی که توسط ماکس بور و فرتینر هابر در سال 1917 جدا از یکدیگر تکوین یافت، میتوان مشاهده کرد. چرخه "بور - هابر" برای تولید کلرید سدیم از عناصر مربوط مورد استفاده قرار میگیرد. تحلیل "بور - هابر" بر اساس قانون هس قرار دارد. قانون هس میگوید که تغییر آنتالپی هر نوع واکنش شیمیایی مقداری است ثابت ، خواه واکنش در یک مرحله و خواه در چند مرحله صورت گیرد.
تغییر آنتالپی تولید یک مول  در یک مرحله از
در یک مرحله از 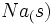 و
و 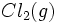 ، آنتالپی تشکیل این ترکیب است.
، آنتالپی تشکیل این ترکیب است.
مراحل تشکیل 
میتوانیم تولید یک مول  را از
را از 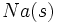 و
و  در چند مرحله تصور کنیم. جمع جبری مقادیر ΔH در این مراحل باید بر اساس قانون هس برابر آنتالپی تشکیل
در چند مرحله تصور کنیم. جمع جبری مقادیر ΔH در این مراحل باید بر اساس قانون هس برابر آنتالپی تشکیل  که مراحل ΔH واکنش در یک مرحله است، باشد. مراحل مزبور به قرار زیر است.
که مراحل ΔH واکنش در یک مرحله است، باشد. مراحل مزبور به قرار زیر است.
-
فلز سدیم بلورین تصعید میشود و به اتمهای گازی سدیم تبدیل میگردد. در این عمل برای هر مول سدیم 108 کیلو ژول انرژی جذب میشود. ( انرژی تصعید سدیم )
-
نیم مول از مولکولهای
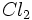 گازی تفکیک میشود و به یک مول اتم Cl گازی تبدیل میگردد. آنتالپی تفکیک
گازی تفکیک میشود و به یک مول اتم Cl گازی تبدیل میگردد. آنتالپی تفکیک  که انرژی پیوندی Cl - Cl نیز نامیده میشود، برابر 243Kj برای هر مول
که انرژی پیوندی Cl - Cl نیز نامیده میشود، برابر 243Kj برای هر مول 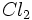 است. از آنجا که تنها نیم مول
است. از آنجا که تنها نیم مول 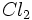 در این عمل مورد نیاز است، انرژی تفکیک نیر نصف میشود. ( 122+ Kj )
در این عمل مورد نیاز است، انرژی تفکیک نیر نصف میشود. ( 122+ Kj ) -
اتمهای سدیم گازی یونیزه میشوند و به یونهای سدیم گازی تبدیل میگردند. مقدار انرژی لازم همان انرژی اولین یونش سدیم است. ( 496+ Kj )
-
اتمهای کلر گازی الکترون میگیرند و به یونهای کلرید گازی تبدیل میشوند. تغییر آنتالپی برای هر مول
 ، برابر اولین الکترون خواهی کلر است. در این فرایند انرژی آزاد میشود، (349 - کیلو ژول) این اولین مرحلهای است که در آن انرژی آزاد میشود. اما انرژی آزاد شده ، انرژیهای مورد نیاز مراحل پیشین را تامین نمیکند.
، برابر اولین الکترون خواهی کلر است. در این فرایند انرژی آزاد میشود، (349 - کیلو ژول) این اولین مرحلهای است که در آن انرژی آزاد میشود. اما انرژی آزاد شده ، انرژیهای مورد نیاز مراحل پیشین را تامین نمیکند. -
در آخرین مرحله ، یونهای گازی بصورت یک مول بلور کلرید سدیم متراکم میشوند. تغییر آنتالپی این عمل یعنی انرژی شبکه
 برابر 788- کیلو ژول است که نشانه آزاد شدن انرژی است. روشن است که بیشتر انرژی آزاد شده در کل واکنش ، از این مرحله ناشی میشود. یعنی این مرحله است که زمینه انجام این فرآیند را از نظر انرژی مساعد میکند.
برابر 788- کیلو ژول است که نشانه آزاد شدن انرژی است. روشن است که بیشتر انرژی آزاد شده در کل واکنش ، از این مرحله ناشی میشود. یعنی این مرحله است که زمینه انجام این فرآیند را از نظر انرژی مساعد میکند.
اگر معادلات گرما شیمیایی مراحل 1 تا 5 را جمع کنیم، نتیجه عبارت از معادله آنتالپی تشکیل خواهد بود، که به صورت زیر است:
خواهد بود، که به صورت زیر است:
مورد استفاده چرخه "بور - هابر"
از چرخههای "بور - هابر" ، برای تحلیل فرآیندها و پی بردن به اینکه تغییر در یک مرحله چه اثری در کل فرآیند خواهد داشت، استفاده میکنند. این چرخهها را میتوان برای محاسبه تغییر آنتالپی یکی از مراحل یا کل فرآیند نیز بکار برد.
مقدار انرژی شبکه
بطورکلی مقدار انرژی شبکه به دو عامل بستگی دارد:
بار یونها
هنگام تشکیل بلور هر چه بار یونهای بوجود آورنده بلور بیشتر باشد، انرژی شبکه زیادتری آزاد میشود. زیرا هر چه قدر مطلق بارهای مثبت و منفی بزرگتر از هم باشد، به همان نسبت جاذبه بین آنها قویتر و انرژی آزاد شده بیشتر است.
اندازه یونها
هر چه فاصله دو بار ناهمنام کمتر باشد، نیروی جاذبه قویتر و انرژی آزاد شده بیشتر خواهد بود. لذا انرژی شبکه بلور ناشی از یونهای کوچکتر که توانایی نزدیکتر شدن دارند، بیش از انرژی شبکه بلور ناشی از یونهای بزرگتر است، به شرط اینکه بار یونهای ترکیب یکسان باشد. از آنجا که یون  کوچکتر از یون
کوچکتر از یون 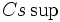 است، اختلاف انرژی شبکه (NaCl (-788Kj/mol و (CsCl (- 669Kj/mol شگفت آور نیست.
است، اختلاف انرژی شبکه (NaCl (-788Kj/mol و (CsCl (- 669Kj/mol شگفت آور نیست.
کلمات کلیدی: ترمو دینامیک
| گرمای جذب شده بوسیله واکنشی که در فشار ثابت انجام میگیرد برابر با تغییر آنتالپی است. آنتالپی ، همانند انرژی داخلی ، تابعی از حالت سیستم و مستقل از راهی است که به آن حالت میرسد. یعنی تابع حالت و یک کمیت شدتی است. |
کار در واکنشهای شیمیایی
برای واکنشهای شیمیایی عادی ، کار عموما ناشی از تغییرات فشار ، حجم است. اگر سیستم (به علت گاز) منبسط شود، در برابر فشار اتمسفر کار انجام میدهد واین نمونهای از کار فشار - حجم است. جمله PV دارای ابعاد کار است. فشار که نیرو بر واحد سطح است، بر حسب نیوتن بر متر مربع N/m2 بیان میشود. اگر حجم بر حسب متر مکعب m3 بیان شده باشد، حاصلضرب PV عبارت خواهد بود از:
(PV=(N/m2)(m3)=N.m(J
نیوتن متر (یک ژول) یک واحد کار است، زیرا کار به صورت حاصلضرب نیرو (نیوتن) در فاصله (متر) تعریف شده است. به طریق مشابه میتوان گفت که لیتر اتمسفر نیز واحد کار است. اگر فشار ثابت بماند و حجم بر اثر انبساط از VA به VB برسد، کار انجام شده عبارت خواهد بود از:
W=P(VB-VA)=P∆V
کار انجام شده در حجم ثابت
هیچ گونه کار فشار ، حجمی نمیتواند بوسیله فرآیندی که در حجم ثابت صورت میگیرد، انجام شود، W=0 خواهد بود. پس در حجم ثابت معادله: E=Q-W∆
به صورت زیر در خواهد آمد: E=QV∆ که در آن qv کار انجام شده در حجم ثابت است.
کار انجام شده در فشار ثابت
در شیمی فرآیندهایی که در فشار ثابت انجام میگیرند، بسیار متداولتر از فرآیندهایی هستند که در حجم ثابت انجام میشوند. اگر ما توجه خود را بکار فشار - حجم متمرکز کنیم، کار انجام شده در فرآیندهایی که در فشار ثابت به صورت P∆V خواهد بود. پس در فشار ثابت معادله
: E=q-W∆ به صورت زیر در خواهد آمد:
E=qp+P∆V∆
اگر در معادله فوق qp را به دست آوریم خواهیم داشت:
که در آن ، گرمای جذب شده بوسیله سیستم در فشار ثابت است.
تابع ترمودینامیکی آنتالپی
تابع ترمودینامیکی آنتالپی ، H ، با معادله زیر معادله زیر تعریف میشود: H=E+PV
بنابراین qp=∆H
یعنی گرمای جذب شده بوسیله سسیتم در واکنش در فشار ثابت:
اعتبار قانون هس نیز براساس آنتالپی استوار است.
رابطه بین تغییرات در آنتالپی و تغییر در انرژی درونی
وقتی که برای اندازه گیریهای گرماسنجی، از گرماسنج بمبی استفاده میکنیم، اثر گرمایی در حجم ثابت اندازه گیری میشود. واکنشهای معمولی در فشار ثابت انجام میشوند. رابطه میان تغییر در آنتالپی و تغییر در انرژی داخلی برای تبدیل گرماهای واکنش در حجم ثابت qv=∆E به گرماهای واکنش در فشار ثابت qp=∆E مورد استفاده قرار میگیرد. این تغییر با توجه به تغییر حجم محصولات واکنش به عمل میآید و این تغییر در حجم مایعات و جامدات به قدری است که میتوان ان را نادیده گرفت.
اما در واکنشهایی که مواد گازی دخالت دارند، تغییر حجم اهمیت پیدا میکند فرض کنید که VqA حجم کلی واکنش دهندههایی گازی ، VqB حجم کلی محصولات گازی ، nA عمده مولهای واکنش دهندههای گاز ، np عده مولهای محصولات گازی و فشار و دما ثابت است. در این صورت E+(∆n)RT∆=∆
که در آن n∆ عده مولهای محصولات منهای عده مولهای واکنش دهندههای گازی است.
آنتالپی تشکیل
یک روش آسان برای محاسبه H∆ یک واکنش ، استفاده از مقادیر ثبت شدهای است که آتالپیهای تشکیل استاندارد نامیده میشود. آنتالپی تشکیل استاندارد (که با نماد H˚f∆ نشان داده میشود) مقدار H∆ مربوط به واکنشی است که در آن یک مول ماده در 1atm و دمای مرجع خاصی از عناصر سازنده آن در پایدارترین شکلی که در فشار 1atm و دمای مرجع دارند، تشکیل میشود. نماد ˚H∆ که مشخص کننده تغییرات آنتالپی استاندارد است، برای واکنشهایی بکار میآید که فقط شامل موادی در حالت استاندارد هستند.
کلمات کلیدی: ترمو دینامیک
| میزان کاتورگی یا بینظمی یک سیستم که به عنوان معیار خودبخودی واکنش بکار میرود، آنتروپی نامیده میشود که برحسب J/K.mol بوده و با S نمایش داده میشود. |
قانون دوم ترمودینامیک و آنتروپی
قانون اول ترمودینامیک به معرفی انرژی درونی ، U ، منجر شد. این کمیت تابع حالتی است که بر مبنای آن ، مجاز بودن یک فرآیند مورد قضاوت قرار میگیرد و بیان میدارد که فقط تحولاتی مجاز است که انرژی داخلی کل سیستم منزوی ، ثابت بماند. قانونی که ملاک خودبخودی بودن را مشخص میسازد (قانون دوم ترمودینامیک) ، برحسب تابع حالت دیگری بیان میشود. این تابع حالت ، آنتروپی ، S ، است.
ملاحظه خواهیم کرد که بر مبنای آنتروپی قضاوت میکنیم که آیا یک حالت بطور خودبخودی از حالت دیگری قابل حصول میباشد. در قانون اول با استفاده از انرژی داخلی ، تحولات مجاز مشخص میشود (آنهایی که انرژی ثابت دارند). از قانون دوم با استفاده از آنتروپی ، تحولات خودبخودی از بین همان فرآیندهایی مشخص میشود که بر مبنای قانون اول مجاز میباشد.
بیان قانون دوم
آنتروپی سیستم منزوی در یک فرآیند خودبخودی افزایش مییابد: 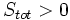
که 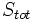 ، آنتروپی تمام قسمتهای سیستم منزوی میباشد.
، آنتروپی تمام قسمتهای سیستم منزوی میباشد.
از آنجایی که فرآیندهای برگشت ناپذیر (مانند سرد شدن شیئی تا دمای محیط و انبساط آزاد گازها) خودبخودی است، در نتیجه همه آنها با افزایش آنتروپی توام میباشند. این نکته را میتوان به این صورت مطرح کرد که در فرایندهای برگشت ناپذیر آنتروپی تولید میشود. از طرف دیگر ، در فرایند برگشت پذیر توازن وجود دارد، یعنی سیستم با محیط در هر مرحله در تعادل است. هر مرحله بسیار کوچک در این مسیر برگشت پذیر بوده و پخش نامنظم انرژی روی نمیدهد و در نتیجه آنتروپی افزایش نمییابد، یعنی در فرآیند برگشت پذیر آنتروپی ایجاد نمیشود. آنتروپی در فرآیندهای برگشت پذیر از بخشی از سیستم منزوی به بخش دیگری منتقل میگردد.
تعریف آماری آنتروپی
بر مبنای تعریف آماری ، فرض میشود که در واقع میتوانیم با استفاده از فرمول ارائه شده توسط لوودیگ بولتزمن (Ludwing Boltzmann) در سال 1896 ، آنتروپی را محاسبه کنیم: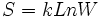
که k، ثابت بولتزمن است: 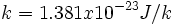
این ثابت به صورت 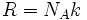 به ثابت گاز ربط دارد. کمیت W تعداد راههای متفاوتی است که سیستم میتواند با توزیع اتمها یا مولکولها بر روی حالتهای در دسترس به انرژی خاصی برسد. واحد آنتروپی با واحد k یکسان است. در نتیجه واحد آنتروپی مولی ،
به ثابت گاز ربط دارد. کمیت W تعداد راههای متفاوتی است که سیستم میتواند با توزیع اتمها یا مولکولها بر روی حالتهای در دسترس به انرژی خاصی برسد. واحد آنتروپی با واحد k یکسان است. در نتیجه واحد آنتروپی مولی ،  میباشد؛ (این با واحد R و ظرفیت گرمایی یکی است.)
میباشد؛ (این با واحد R و ظرفیت گرمایی یکی است.)
تعریف ترمودینامیکی انرژی
در روش ترمودینامیکی ، تمرکز بر روی تغییر آنتروپی در طول یک فرایند ، dS ، میباشد، نه مقدار معلق S. تعریف dS بر این مبناست که میتوان میزان پخش انرژی را به انرژی مبادله شده به صورت گرما ، در حین انجام فرایند ربط داد. تعاریف آماری و ترمودینامیکی با هم سازگار میباشند. در شیمی فیزیک این یک لحظه نشاط آور است که بین خواص تودهای (که مورد نظر ترمودینامیک است) و خواص اتمها یک ارتباط برقرار شود.
تغییر آنتروپی محیط
تغییر آنتروپی محیط را با علامت "dS نشان میدهیم. علامت پریم مربوط به محیط سیستم واقعی که در سیستم منزوی بزرگ قرار دارد، مربوط میشود. محیط را با یک مخزن حرارتی بزرگ (عملا یک حمام آب) نشان میدهیم که در دمای T باقی میماند. مقدار گرمای منتقل شده به مخزن در اثر انجام کار مانند سقوط یک وزنه را با "dq نشان میدهیم که این گرما به مخزن منتقل میشود. هرچه مقدار گرمای بیشتری به مخزن منتقل شود، حرکت حرارتی بیشتری هم در آن ایجاد میشود و از این رو ، پخش انرژی به میزان بیشتری اتفاق میافتد. از این نکته استنباط میشود که:
اگر گرما به مخزن سردی منتقل شود، کیفیت انرژی نسبت به موردی که آن گرما به مخزن گرمتری داده شود، انحطاط بیشتری خواهد داشت. در مورد اخیر میتوانیم در اثر جاری شدن گرمای "dq از یک مخزن سرد به مخزن سردتری کار استخراج کنیم، اما اگر این گرما مستقما به مخزن سردتر منتقل شود، استخراج چنین کاری امکان پذیر نیست.
نتیجه میگیریم که اگر مقدار معین انرژی به صورت گرما به مخزن گرمی داده شود، آنتروپی کمتری ایجاد میشود تا اینکه آن انرژی به مخزن سردی داده شود. سادهترین راهی که میتوان این وابستگی دمایی را به حساب آورد، چنین است: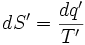
که "T دمایی است که در آن دما ، انتقال گرما صورت گرفته است. برای یک تغییر قابل اندازه گیری در دمای ثابت چنین داریم:
وقتی که مقدار زیادی حرکت حرارتی در دمای پایین ایجاد شود، تغییر آنتروپی بزرگی اتفاق میافتد. برای فرآیند آدیاباتیک:
0 = "q وقتی 0 = "S∆
این نتیجه برای هر فرآیندی ، برگشت پذیر یا برگشت ناپذیر ، صحیح است، تا زمانی که مناطق گرم محلی در محیط ایجاد نشود، یعنی زمانی این نتیجه صحیح است که محیط ، تعادل درونی خود را حفظ کند. اگر مناطقی محلی بوجود آید، انرژی از این مناطق بطور خودبخودی پخش میشود و در نتیجه آن آنتروپی تولید میشود. موقعی که یک واکنش شیمیایی با تغییر آنتالپی H∆ در سیستمی انجام میشود، گرمایی که در فشار ثابت وارد محیط میشود، برابر با 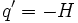 . بنابراین تغییر آنتروپی محیط برابر است با:
. بنابراین تغییر آنتروپی محیط برابر است با:
کلمات کلیدی: ترمو دینامیک
نگاه اجمالی
ستاره شناسان اکثر مطالعات مفصل فضایی خود را از طریق رصدخانهها انجام میدهند. محل رصدخانه یکی از مهمترین خصوصیات آن است زیرا تلسکوپها باید دور از نور شهرها مستقر شوند تا نور ضعیف ستارگان تحت شعاع قرار نگیرد. رصدخانهها اغلب در کنار اقیانوس ساخته میشوند، زیرا هوای آنجا ثابتتر است و ستارگان کمتر سوسو میزنند، در نتیجه تصاویر شفافتری بدست میآیند.
در آنجا تلسکوپها ، نوری را که از سیارهها ، ستارگان و کهکشانهای دور دست میرسد، جمع میکنند. رصدخانه ، ساختمان ویژهای به شکل گنبد دارد تا تلسکوپها را از باد ، باران و برف حفظ کند. در گنبد رصدخانه دریچهای هست که از راه آن ، تلسکوپ را متوجه آسمان میکنند. در یک رصدخانه بزرگ ، چندین تلسکوپ بکار گرفته میشود، تا هر کدام به شیوهای مخصوص مورد استفاده اخترشناسان قرار گیرند.
شرایط یک رصدخانه
رصدخانههای مهم بر فراز کوهها بنا میشوند تا از مزاحمت ابرها به دور باشند. در کوهستان ، روشنایی شهر و خیابانهای آن نیز به حداقل میرسد. گاهی اختر شناسان برای رسیدن به تلسکوپهای خود ، هزاران کیلومتر راه طی میکنند. یک رصدخانه جدید علاوه بر اخترشناس ، به اشخاص دیگری برای کار با کامپیوترها ، ساختن تجهیزات و راه اندازی تلسکوپها نیاز دارد. کار با کامپیوترها نه تنها در نشانه روی خودکار تلسکوپ به طرف اجرام آسمانی بلکه در محاسبات بسیار مشکل به اخترشناس کمک میکنند.
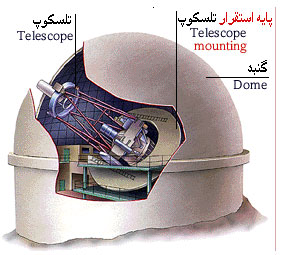 |
|
گنبد گران رصدخانه از تجهیزات در برابر عناصر طبیعی محافظت میکند. باز شدن شکاف سقف آن تلسکوب را آشکار میکند. |
رصدخانههای معروف
رصدخانه ماونت پالومار
رصدخانه مشهور «ماونت پالومار» ، در کالیفرنیای جنوبی و در 160 کیلومتری لسآنجلس واقع است. اختر شناسان آمریکا ، رصدخانه جدیدی در آریزونا و بر فراز کوهستان «کیت پیک» تأسیس کردهاند. در حومه شهر توسکان ، چراغهای خیابانها را بخاطر این تلسکوپ به حداقل میرسانند. تلسکوپهای مهم بریتانیا ، در رصدخانه سلطنتی گرینویچ قرار دارد.
رصدخانه سارس ویلز
با همکاری مشترک اخترشناسان بریتانیا ، رصدخانهای در «سارس ویلز جدید» بر پا شده است. چهارمین تلسکوپ بزرگ جهان با آینهای به قطر 3.9 متر در این رصدخانه است. در زیر گنبد آن تأسیسات دیگری مانند کتابخانه ، آشپزخانه و تاریکخانه برای ظهور عکسهای تهیه شده وجود دارد. اخترشناسان با فرا رسیدن روز ، در ساختمان مجاور این گنبد عظیم به استراحت میپردازند.
رصدخانههای نیمکره جنوبی
برای آنکه اطلاعات بیشتری از ستارگان و کهکشانهای آسمانی نیمکره جنوبی بدست آید. در آمریکای جنوبی ، استرالیا و جزایر قناری نیز رصدخانههای جدیدی ساختهاند. رصدخانههای جدیدی که در هوای صاف کوهستان «آند» در شیلی واقعند، به کاوش آسمان نیمکره جنوبی میپردازند. هر کدام از آنها به تلسکوپهای بسیار مدرن ، مجهز هستند. به این ترتیب از آسمان نیمکره جنوبی ، میتوان عکسهایی با کیفیت خوب تهیه کرد.
رصدخانههای رادیویی
بسیاری از کهکشانها ، موج رادیویی گسیل می کنند. این امواج با تلسکوپهای رادیویی بزرگ ، آشکار می شوند. خوشبختانه ، ابرها جلوی موج رادیویی را نمی گیرند. از این رو می توان رصدخانههای مخصوص اختر شناسی رادیویی را در نواحی ابرآلود نیز بنا کرد. در انگلستان ، رصدخانه های رادیویی بزرگی نزدیک منچستر و نیز کمبریج وجود دارد. چندین رصدخانه بزرگ هم ایالات متحد آمریکا ، روسیه و استرالیا مشغول کاوش هستند. از تلسکوپهای رادیویی نه تنها به هنگام شب بلکه در روز نیز می توان استفاده کرد.
مائوناکیا
ستاره شناسان کشورهای مختلفی از رصدخانه مدرن مائوناکیا در آتشفشانی خاموش در هاوایی استفاده میکنند. این رصدخانه 4200 متر (13800 پا) بالاتر از سطح دریا ، یعنی بالاتر از اکثر ابرها و در جزیرهای محصور با اقیانوس آرام قرار دارد. این شرایط ، مائوناکیا را یکی از بهترین محلهای رصد فضایی دنیا نموده است. مائوناکیا تصاویر فوق العاده شفافی از اجرام سماوی عرضه میکند. بخاطر استقرار این رصدخانه در چنان ارتفاعی ، تلسکوپهایش میتوانند تشعشع مادون قرمز و مایکروویو را که توسط لایههای تحتانی جو متوقف میشوند، دریافت کنند.
 |
|
در میان تلسکوپهای مائوناکیا 5 دستگاه از بزرگترین تلسکوپهای دنیا از جمله تلسکوپ «کک» وجود دارد که آینهای به عرض 10 متر دارد. |
پرتوهای x نمی توانند در جو زمین نفوذ بیشتری کنند. برای آشکار کردن آنها ، دانشمندان فضاشناس ، رصدخانههای خودکار ساخته اند. این رصدخانهها در ارتفاع بسیار ، زمین را دور می زنند. تلسکوپهای آنها به کمک علائم رادیویی از زمین کنترل میشود و پرتوهای نامرئی x ستارگان را بررسی میکند. اخترشناسان امیدوارند که روزی رصدخانههایی شامل چندین نوع تلسکوپ به دور زمین روانه کنند. در این صورت چگونگی هوا بر کار اخترشناسان تأثیر نخواهد گذاشت.
کلمات کلیدی: اختر فیزیک، هواشناسی و اختر فیزیک



.GIF)