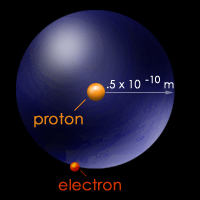
* مطالب علمی *
ایساتیس
آقاشیر
.: شهر عشق :.
جملات زیبا
تعقل و تفکر
دکتر رحمت سخنی
بیگانه ، دختری در میان مردمان
تا ریشه هست، جوانه باید زد...
اس ام اس عاشقانه
خاطرات خاشعات
اس ام اس سرکاری اس ام اس خنده دار و اس ام اس طنز
وسوسه عقل
پرهیزکار عاشق است !
فروش و تعمیر موبایل در استان یزد
آموزش
وبلاگ تخصصی کامپیوتر
هک و ترفند
فروش و تعمیر موبایل در استان یزد
انجمن فیزیک پژوهش سرای بشرویه
عاشقان خدا فراری و گریزان به سوی عشق و حق®
وبلاگ عشق و محبت ( اقا افشین)
باید زیست
دست نوشته های دو میوه خوشمزه
در دل نهفته ها
روزگاران(حتما یه سری بهش بزن ضرر نمی کنی)
فقط برای ادد لیستم...سند تو ال
تجربه های مدیریت
سولات تخصصی امتحان دکترا دانشگاه آزاد
سولات تخصصی امتحان دکترا دانشگاه آزاد
ارزانترین و بزرگترین مرکز سوالات آزمون دکترا
عکس و اس ام اس عشقولانه
دانلود نرم افزار های روز دنیا
شاهرخ
مکانیک هوافضا اخترفیزیک
مکانیک ، هوافضا ،اخترفیزیک
وبلاگ تخصصی فیزیک و اختر فیزیک
وبلاگ تخصصی فیزیک جامدات
همه با هم برای از بین نرفتن فرهنگ ایرانی
انتخاب
فیزیک و واقعیت
ترجمه متون کوتاه انگلیسی
دنیای بیکران فیزیک
وقتی جسم کدری میان یک پرده و یک چشمه نقطهای نور قرار گیرد، سایهای پیچیده متشکل از نواحی روشن و تاریک ایجاد میشود. این اثر به آسانی قابل روییت است، اما یک چشمه نسبتا قوی ضروری است. لامپی با شدت زیاد که از یک سوراخ کوچک میدرخشد، این کار را به خوبی انجام میدهد. اگر به نقش سایه حاصل از یک قلم ، تحت روشنایی یک چشمه نقطهای نگاه کنید یک ناحیه روشن غیر معمولی در کناره خواهید دید.
حتی نواری با روشنایی ضعیف در وسط این سایه تشکیل میشود. به سایهای که توسط دستتان در امتداد نور خورشید ایجاد میشود، نگاهی دقیق بیندازید. معمولا پراش مربوط به موانع شفاف مورد نظر قرار نمیگیرد. هر چند اگر در شب رانندگی کرده باشید، در حالیکه چند قطره باران بر روی شیشه عینکتان نشسته باشد، فریزهای روشن و تاریک را مشاهده خواهید کرد.
تاریخچه
اولین مطالعه تفضیلی منتشر شده درباره انحراف نور از مسیر مستقیم توسط فرانسسیکو گریمالدی در قرن هفدهم انجام گرفت و آن را پراشه نامید.
انواع پراش
پراش فرانهوفر
فرض کنید که یک مانع کدر حاوی یک روزنه کوچک داریم که امواج تخت حاصل از یک چشمه نقطهای شکل خیلی دور (S) ، آن را روشن کرده است. صفحه مشاهده ، پردهای است موازات با مانع کدر ، دورتر بودن صفحه مشاهده به آرامی باعث تغییر پیوسته در فریزها میشود. در فاصله خیلی دور از مانع نقش تصویر شده بطور قابل ملاحظهای پخش خواهد شد. بطوری که به روزنه واقعی بیشباهت است و یا شباهت اندکی با آن خواهد داشت. از آنجا به بعد حرکت دادن پرده تنها اندازه نقش پراش را تغییر میدهد ولی شکل آن را بدون تغییر میگذارد. این پراش را فرانهوفر یا پراش میدان- دور میگویند.
پراش فرنهوفر تک شکاف
در این نمونه شکاف مستطیل شکل که پهنای کوچک و طول چند سانتی متردارد، در مقابل منبع نور قرار میگیرد. پرتوهای نور بعد از عبور از شکاف بر روی پرده تشکیل تصویر میدهند، که قسمت مرکزی در مقایسه با کنارهها شدت بیشتری دارد. نقشهای پراش در اطراف این ناحیه بوضوح دیده میشود و ضمن اینکه شدت نور با دور شدن از ناحیه مرکزی کاهش ییابد، نوارهای تاریک در بین نوارهای روشن قابل روییت است.
شکاف دوگانه
در این نمونه مانع کدر که در مقابل نور قرار میگیرد از دو شکاف مستطیل شکل موازی تشکیل شده است. هر روزنه به خودی خود همان نقش پراش تک شکافی را روی پرده دید ایجاد خواهد کرد. در هر نقطه روی پرده سهمهای مربوط به این دو شکاف روی هم میافتد. گرچه دامنه هر کدام از آنها اساسا باید باهم مساوی باشد، ممکن است اختلاف فاز قابل توجهی پیدا کنند. در داخل قله مرکزی پراش وجود خواهد داشت. ممکن است یک بیشینه تداخل و یک کمینه پراش با یک مقدار از (زاویه انحراف از قسمت مرکزی) متناظر باشند. در چنین حالتی نوری وجود ندارد، که در آن موقعیت دقیق در تداخل شرکت کند و قله حذف شده را مرتبه گم شده مینامند.
پراش فرنل
فرض کنید یک مانع کدر حاوی روزنه کوچک که اموج تخت حاصل از یک چشمه نقطهای شکل خیلی دور (S) ، آن را روشن کرده است. در این حالت صفحه مشاهده پردهای موازی با مانع است. در این شرایط یک تصویر از روزنه بر روی پرده میافتد، که علیرغم وجود برخی فریزهای جزیی در اطراف محیط آن ، به روشنی قابل تشخیص است. بتدریج که صفحه مشاهده از مانع دور میشود، تصویر روزنه گر چه هنوز به راحتی قابل تشخیص است، هرچه شکل مشخصتری به خود میگیرد، و این در حالی است که فریزها نمایانتر میشوند. این پدیده مشاهده شده پراش فرنل یا میدان- نزدیک نامیده میشود.
اصل بابینه
دو پرده پراشان را مکمل میگویند، هرگاه نواحی شفاف روی یک پرده با نواحی کدر پرده دیگر و بر عکس متناظر باشند. وقتی که دو پرده مکمل روی هم بیافتند، آشکار است که ترکیب آنها کاملا کدر است.
توری پراش
آرایهای تکراری از عناصر پراشان ، نظیر روزنهها یا موانعی که اثر آنها ایجاد تغییرات متناوبی در فاز ، دامنه یا هر دوی آنها در یک موج خروجی است، یک توری پراش نامیده میشود. غالبا توریهای تخت تراشهای ، یا شیارهایی تقریبا مستطیلی چنان سوار میشوند که بردار انتشار فرودی تقریبا بر هر یک از وجوه شیارها عمود باشند.
کلمات کلیدی: اپتیک
مقدمه:
همه کم و بیش درکی شهودی از مفاهیم گرما ، فشار و حتی انرژی درونی داریم اما به نظر می رسد در خصوص مفهوم فیزیکی آنتالپی این گونه نباشد! برای نزدیک شدن به این درک ، قانون اول ترمودینامیک را در نظر بگیرید. همان طور که می دانیم این قانون در واقع بیانی است از قانون پایستگی انرژی و با این توضیح اضافی که گرما نیز صورتی از انرژی است. این قانون را به طور کمی به صورت dQ=dU+dW بیان می کنند که در آن d معرف تفاضل یا اختلاف است. همچنین کمیت های W,U,Q به ترتیب گرما ، انرژی درونی و کار را نشان می دهند. هر گاه در فشار ثابت حجم دستگاهی به مقدار کوچکی تغییر کند، دستگاه به اندازه ی dW=PdV روی محیط کار انجام می دهد و یا بر عکس از طرف محیط روی دستگاه کار انجام می شود. حال فرض کنید در یک فرایند هم فشار انرژی درونی و حجم دستگاهی تغییر کند. در این صورت به کمک قانون اول ترمودینامیک و رابطه ی کار در فرایند هم فشار به سادگی به رابطه ی (dQ=d(U+PV می رسیم که کمیت داخل پرانتز یعنی U+PV را با H نشان می دهند و آن را آنتالپی می نامند. در این صورت داریم dQ=dH . بنابراین ، هرگاه فرایندی هم فشار بر روی دستگاهی انجام شود گرمای داده شده یا گرفته شده از دستگاه با تغییر انتالپی آن برابر است. از همین رو آنتالپی را محتوای گرمایی دستگاه نیز می نامند! از آنجا که در شیمی و مهندسی بیشتر فرایندها در فشار ثابت انجام می شود مفهوم آنتالپی کاربرد زیادی دارد.
تعریف آنتالپی
آنتالپی سیستم، تابعی ترمودینامیکی است که با مجموع انرژی درونی سیستم و حاصلضرب حجم در فشار آن (در فشار ثلبت) در محیط سیستم، هم ارز است. به عبارت دیگر گرمای جذب شده بوسیله واکنشی که در فشار ثابت انجام میگیرد، برابر با تغییر آنتالپی سیستم است. آنتالپی، همانند انرژی داخلی، تابعی از حالت سیستم و مستقل از راهی است که به آن حالت میرسد.
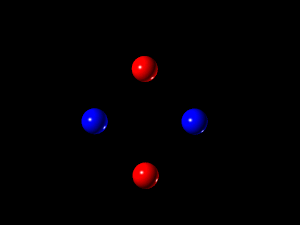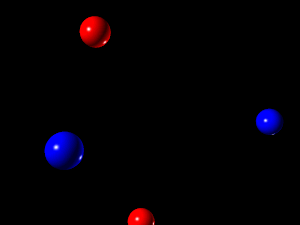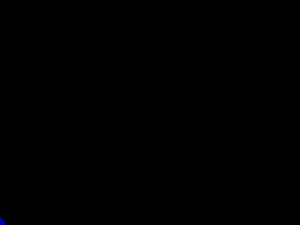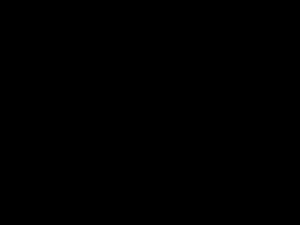
حالت های ماده
هر سیستمی اعم از جامد، مایع و گاز شامل اتمها یا یونها و یا مولکولهای ساده ای است که بهم دو نوع نیروی مختلف اعمال می کنند:
1- جاذبه ی بین ذرات
2- انرژی جنبشی
جاذبه ی بین ذرات
جاذبه ی بین اتمها، یونها و ملکولها به موارد زیر تقسیم می شود:
لف: کنش یونی
ب: قید هیدروژنی ( بویژه کنش دو قطبی)
ج: کنش دو قطبی
د: تحریک شدن ناپایدار کنش دو قطبی
انرژی جنبشی
انرژی جنبشی طبق رابطه ی زیر داده می شود:
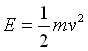
انرژی جنبشی مستقیماً با دمای مطلق متناسب است، زیر سرعت مولکولی (u) یک گاز کامل از رابطه زیر به دست می آید:
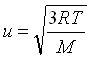
M جرم مولی
حالت های جامد، مایع و گاز
در حالت جامد، نیروی جاذبه مولکولی بر نیروی جنبش مولکولی غلبه دارد و موجب می شود اتمها یا مولکولها در مجاورت یکدیگر باقی بمانند.
-
در اینجا هندسه ی ثابتی در همسایگی اتمها وجود دارد
-
مجموعه ی اتمها دارای شکل و حجم معینی هستند
در مایعات انرژی جنبشی بیشتر از حالت جامدات است. این انرژی آن اندازه نیست که مولکولها را از هم جدا کند و به اندازه هم کم نیست که مولکولها در محاورت یکدیگر ثابت بمانند.
-
در اینجا هندسه ی ثابتی در همسایگی اتمها وجود ندارد
-
مجموعه ی اتمها دارای شکل ثابتی نیست، اما دارای حجم ثابتی هستند
-
جامد و ماده هر دو حالتهای فشرده ی ماده هستند.
در گازها انرژی جنبشی در یک نقطه بیشتر از نیروهای جاذبه است، بطوریکه اتمها و مولکولها کاملاً از یکدیگر جدا می شوند.
-
مجموعه اتمها منبسط می شوند و حجم فضایی را که در آن قرار دارند، اشغال می کنند.
انرژی درونی و تبادل حرارتی
اگر به یک سیستم انرژی گرمایی (q) داده شود، انرژی درونی آن (U) افزایش می یابد، و اگر سیستم روی محیط کار (w) انجام دهد، انرژی درونی آن کاهش می یابد بطوریکه:
dU = dq + dw
که در آن کار انجام توسط سیستم منفی در نظر گرفته می شود.
برای یک سیستم پتانسیلی که کار انبساطی انجام دهد، آنتالپی (H) آن بصورت زیر تعریف می شود.
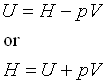
در اینجا P فشار و V حجم سیستم است.
PV نوعی انرژی است که به حاصلضرب فشار در حجم سیستم مربوط می شود و کار انجام می دهد.
در یک فشار ثابت، تغییرات آنتالپی (dH) یک سیستم برابر با گرمای اعمال شده بر سیستم.
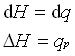
![]()
بنابراین برای تغییرات جزئی سیستم داریم:
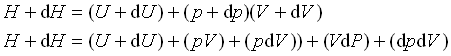
dpdV حاصلضرب دو مقدار کوچک است که با صرف نظر کردن از آن خواهیم داشت:
![]()
![]()
بنابراین
![]()
با جایگذاری (dq + dw) بجای dU خواهیم داشت
![]()
به شرط بودن فشار ، dp برابر صفر خواهد شد و داریم:
![]()
در نهایت به قسمت dw توج کنید. اگر سیستم هیچگونه کار الکتریکی یا مکانیکی و.. انجام ندهد، تنها کاری که می تواند انجام دهد، کار ناشی از pV (انبساط) است. در صورت ثابت بودن فشار، کار ناشی از انبساط تنها به pdV مربوط خواهد شد.، و هرگاه کار انجام شده منفی باشد، pdV نیز منفی خواهد شد.
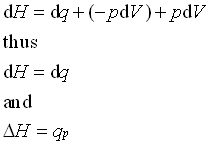
برای یک سیستم در فشار ثابت، تغییرات آنتالپی سیستم برابر با گرمایی است که به سیستم داده می شود.
تبادی حرارتی و تغییر حالت
اگر به مقدار حرارت کسب شده و دمای ماده بررسی شود، می توان ظرفیت گرمایی مواد را اندازه گیری کرد.
-
برای مثال مقدار حرارت لازم برای آنکه فشار در طی یک فرایند ثابت بماند.
-
ظرفیت گرمایی در فشار ثابت Cp و گرمای لازم بصورت زیر تعریف می شود.
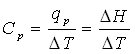
-
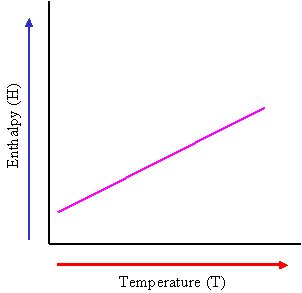
بنابراین Cp برابر شیب نمودار آنتلپی (H) و دما (T) است.
برای بسیاری از مواد، ظرفیت گرمایی در فشار ثابت در هر دمای اختیاری T برابر است با شیب منحنی نمودار آنتالپی و دما.
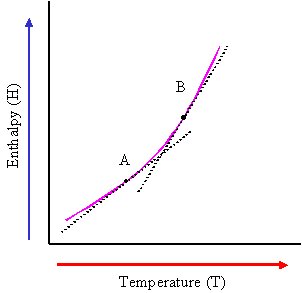
-
بنابراین روابط بیشتر بصورت های زیر خواهد بود:
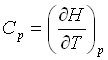
و بالعکس، تغییرا آنتالپی برای رفتن از دمای (T1) به دمای (T2) تابع ظرفیت گرمایی ماده است.
-
هنگامیکه Cp در یک محدوده ثابت باشد، خواهیم داشت:
![]()
-
در حالت کلی که ظرفیت گرمایی Cp تابع دما است با انتگرال گیری از Cp بصورت تابعی از دما خواهیم داشت:
![]()
بنابراین ظرفیت گرمایی در فشار ثابت مشتق آنتالپی نسبت به دما است. و تغییرات آنتالپی انتگرال ظرفیت گرمایی در فشار ثابت است.
حالت تغییرات آب
اگر آب را از حالت جامد آن (یخ) از 25°C- مورد بررسی قرار دهیم، و به آن تا +125°Cحرارت بدهیم، (در فشار یک آتمسفر) داده های به دست آمده شبیه نمودار زیر خواهد شد.
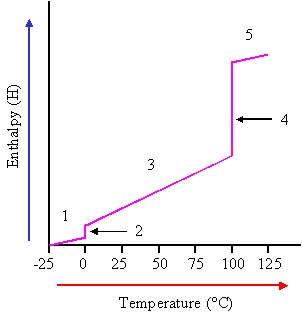
در تمام مراحل این فرایند، فشار ثابت است.
1- بین منفی 25°C تا o°C شیب نمودار ثابت است.
Cp=37.6 J mol-1 K-1
2- در o°C چنین به نظر می رسد که گرمای ویژه نامحدود است.
اما آزمایش نشان می دهد که گرمای ذوب (تابع آنتالپی یخ) 6.01 kJ mol-1 است.
3- بین صفر تا 100 درجه ی سانتیگراد ظرفیت گرمایی آب برابر است با:
75.2 J mol-1 K-1
4- دو باره در 100 ئرجه ی سانتیگراد چنین به نظر می رسد که گرمای ویژه ی آب ( آب جوش) بی نهایت است. اما تجربه نشان می دهد که با گرفتن مقداری گرما از حالت مایع به حالت بخار در می آید. و برای آنتالپی تبخیر داریم:
40.7 kJ mol-1
حال به فرایند زیر توجه کنید که در آن اکسیژن و هیدروژن با یکدیگر ترکیب شده و آب تولید می کنند. در اینجا نیز فشار ثابت است، اما آنتالپی سیستم تغییر می کند.
در این فرایند که تبدیل گاز به مایع است فشار ثابت می باشد و آنتالپی سیستم تغییر می کند.
کلمات کلیدی: ترمو دینامیک
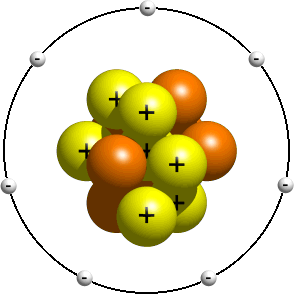
بطور کلی در جدول تناوبی شعاع اتمی از چپ به راست (در یک دوره) کاهش یافته و برعکس از بالا به پائین در یک گروه معین افزایش مییابد. اتمها با از دست دادن یا گرفتن الکترون تبدیل به کاتیون یا آنیون میشوند. یونهای منفی همیشه از اتمهای خود بزرگترند، در حالیکه اندازه یونهای مثبت همیشه کوچکتر از اتمهای اولیه است.
اندازه گیری شعاع اتمی (شعاع کووالانسی)
تعیین اندازه یک اتم ، مسئله مشکلی میباشد. اگر اتم بصورت یک کره فرض شود، شعاع اتمی را باید فاصله بین مرکز هسته و دورترین مکانی که احتمال یافتن الکترون در آن وجود دارد، در نظر گرفت ولی تراکم ابر الکترونی در اتمها متغیر میباشد و احتمال یافتن الکترون تا بینهایت وجود دارد. از اینرو جدا کردن یک اتم تنها و اندازهگیری آن غیر ممکن میباشد.برای اندازه گیری شعاع اتم ، اندازه گیری فاصله بین هستههای دو اتم که باهم پیوند کووالانسی تشکیل دادهاند امکانپذیر میباشد. با تقسیم کردن طول پیوند بر 2 ، شعاع اتمی که شعاع کووالانسی هم نامیده میشود بدست میآید.
بعنوان مثال طول پیوند Cl- Cl برابر با
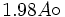 میباشد که با نصف کردن آن ، شعاع اتمی کلر بدست میآید. (
میباشد که با نصف کردن آن ، شعاع اتمی کلر بدست میآید. ( ) اگر شعاع اتمی کلر از طول پیوندی که کلر با اتم دیگری مثل کربن ایجاد کرده است، کم شود شعاع اتمی کربن بدست میآید. البته استفاده از این روش نارساییهایی هم بهمراه دارد، زیرا شعاع اتمی موثر یک عنصر در پیوند با اتمهای مختلف ممکن است متفاوت باشد. ولی بطور کلی این روش برای تعیین روال تغییرات اندازه اتمی روش مفیدی میباشد.
) اگر شعاع اتمی کلر از طول پیوندی که کلر با اتم دیگری مثل کربن ایجاد کرده است، کم شود شعاع اتمی کربن بدست میآید. البته استفاده از این روش نارساییهایی هم بهمراه دارد، زیرا شعاع اتمی موثر یک عنصر در پیوند با اتمهای مختلف ممکن است متفاوت باشد. ولی بطور کلی این روش برای تعیین روال تغییرات اندازه اتمی روش مفیدی میباشد. شعاع یونی
هرگاه الکترونگاتیوی اتمهایی که در پیوند شرکت دارند، تفاوت زیادی با هم داشته باشد، بین آنها انتقال الکترون برای یونهای با بار مخالف صورت میگیرد. معمولا از ترکیب یک فلز با انرژی یونش پائین و یک نافلز با الکترونگاتیوی بالا ، پیوند یونی تشکیل میشود. تهیه نمونهای از یک ماده تشکیل شده از یک نوع یون برای تعیین شعاع یونی کاری بس دشوار است.اما با مطالعه پراش اشعه ایکس میتوان فاصله مراکز یونهای مماس با یکدیگر را بدست آورد. البته تعیین سهم هر یک از یونها در این طول پیوند (یعنی شعاع هر یک از یونها) آسان نیست. در بلورهای یونی ، برخلاف مولکولهای کووالانسی که از نصف کردن طول پیوند دو اتم یکسان ، شعاع کووالانسی بدست میآید اندازه یونهای مثبت و منفی متفاوت میباشد و تقسیم فاصله دو یون بطور مساوی نمیتواند صحیح باشد.
روش تعیین شعاع یونی
برای حل این مساله میتوان ترکیبی مثل لیتیم یدید را در نظر گرفت که اندازه کاتیون خیلی کوچک و اندازه آنیون خیلی بزرگ میباشد. در این صورت فرض میشود که یونهای ید با یکدیگر مماس هستند و از تقسیم فاصله بین دو آنیون یدید بر دو شعاع یون یدید بدست میآید، البته این روش نمیتواند برای تقسیم فاصله بین دو آنیون در بلورهای معمولی بکار رود. زیرا در این ترکیبات ، آنیونها باهم در تماس نمیباشند.اما با معلوم شدن شعاع یون یدید میتوان شعاعهای کاتیونی را با در دست داشتن فواصل بین هستهای مشاهده شده برای ترکیباتی مثل
 که به خاطر بزرگ بودن کاتیونها ، آنیونها با هم در تماس نیستند، بدست آورد و از شعاعهای R
که به خاطر بزرگ بودن کاتیونها ، آنیونها با هم در تماس نیستند، بدست آورد و از شعاعهای R  میتوان شعاعهای
میتوان شعاعهای  و … را تعیین کرد.
و … را تعیین کرد. کلمات کلیدی: هسته ای
 |
|
|
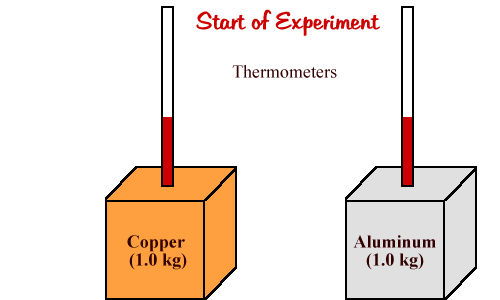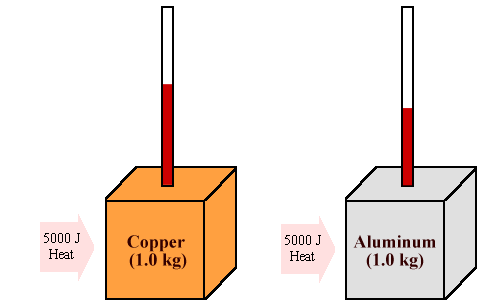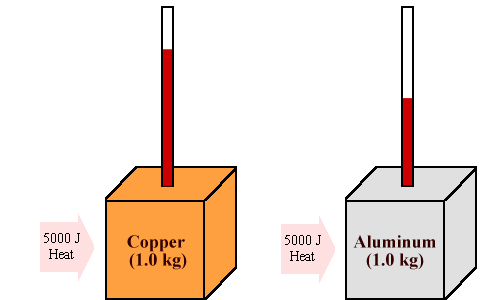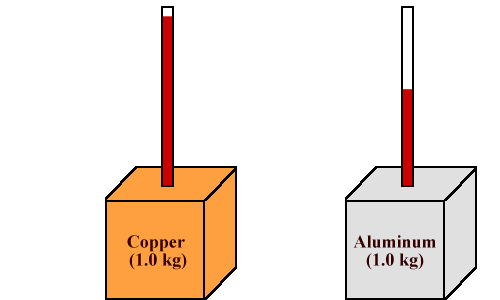
| مقدار گرمایی که لازم است تا دمای یک جسم را به اندازه یک درجه افزایش دهد، به عنوان ظرفیت گرمایی تعریف میشود که آن را با حرف C نشان میدهند. ظرفیت گرمایی ، ترجمه واژه لاتین Heat Conductivity میباشد. |
مقدمه
"ژول" با آزمایش نشان داد که هرگاه مقدار معینی از انرژی مکانیکی به گرما تبدیل شود، مقدار گرمای حاصل همیشه یکسان است. بنابراین همارزی گرما و کار مکانیکی بهعنوان دو شکل انرژی ، کاملا محرز است. "هلمهولتز" اولین کسی بود که بوضوح بیان کرد که نهتنها گرما و انرژی مکانیکی ، بلکه تمام شکلهای انرژی همارزند و مقدار معینی از یک شکل انرژی از بین نمیرود، مگر آنکه همان مقدار در یکی از شکلهای دیگر انرژی ظاهر شود. بنابراین گرما صورتی از انرژی است.
حال اگر چنانچه بخواهیم دمای جسمی را به اندازه واحد افزایش دهیم، در این صورت بسته به نوع جسم ، این مقدار گرما متفاوت خواهد بود. کلمه ظرفیت در ظرفیت گرمایی بویژه گمراه کننده است، چون عبارت مقدار گرمایی را که یک جسم میتواند نگه دارد، به یاد میآورد که اساسا بیمعنا است.
اصولا میتوان ظرفیت گرمایی را بهعنوان یک ثابت تناسب در نظر گرفت، یعنی مقدار گرمای داده شده به یک جسم با تغییر دمای آن جسم متناسب است و با ضرب کردن ظرفیت گرمایی در طرف دوم این رابطه ، رابطه تناسبی به یک تساوی تبدیل میشود، یعنی نسبت مقدار انرژی گرمایی( ) که به یک جسم داده میشود، بر افزایش دمای متناظر با آن(
) که به یک جسم داده میشود، بر افزایش دمای متناظر با آن( ) را ظرفیت گرمایی آن جسم میگویند.
) را ظرفیت گرمایی آن جسم میگویند.
 |
|
|
ظرفیت گرمایی ویژه
ظرفیت گرمایی واحد جرم یک جسم را ظرفیت گرمایی ویژه آن جسم میگویند. ظرفیت گرمایی ویژه ، مشخصه مادهایست که جسم را تشکیل داده است. در مورد یک سکه از ظرفیت گرمایی صحبت میکنیم، ولی در مورد ماده تشکیل دهنده آن یعنی مس ، گفتگو از ظرفیت گرمایی ویژه مناسبت ندارد. ظرفیت گرمایی یک جسم و ظرفیت گرمایی ویژه یک ماده ، هیچکدام ثابت نیستند و به محل بازده دمایی بستگی دارند.
مشخصات ظرفیت گرمایی
ظرفیت ، یک مقدار عددی است که واحد آن بر اساس تعریف واحد گرما و واحد دما بیان میشود. معمولا گرما را برحسب کالری بیان میکنند و کالری طبق تعریف مقدار گرمایی است که باید به یک گرم آب داده شود تا دمای آن را به اندازه یک درجه سانتیگراد بالا ببرد. بر این اساس مقدار گرمای لازم برای افزایش دمای یک کیلوگرم آب به اندازه یک درجه سانتیگراد ، کیلوکالری نامیده میشود.
دما را نیز برحسب واحد کلوین بیان میکنند، البته دما را برحسب درجه سانتیگراد نیز میتوان بیان کرد. لذا واحد ظرفیت گرمایی 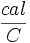 خواهد بود.
خواهد بود.
ظرفیت گرمایی مولی جامدات
یک مول از هر ماده ، مقداری از آن ماده است که شامل تعداد معینی از موجودات بنیادی ، یعنی عدد آووگادرو باشد. این عدد ، حاصل این تعریف است که یک مول از اتمهای کربن (ایزوتوپ کربن 12) دقیقا 12گرم جرم دارد. در سال 1198- 1819، "دولون" و "پتی" خاطر نشان کردند که ظرفیت گرمایی مولی تمام عناصر ، به استثنای چند مورد ، مقادیری در حدود  دارند. ظرفیت گرمایی مولی از ضرب کردن گرمای ویژه در وزن مولکولی بدست میآید.
دارند. ظرفیت گرمایی مولی از ضرب کردن گرمای ویژه در وزن مولکولی بدست میآید.
در عمل ظرفیتهای گرمایی مولی با دما تغییر میکنند، یعنی وقتی که دما به طرف صفر کلوین میل میکند، آنها به صفر و وقتی که دما به بینهایت میل میکند، آنها به مقدار دولون _ پتی نزدیک میشوند. چون به نظر میرسد که در تعیین گرمای لازم برای افزایش دمای یک جسم به مقدار معین ، تعداد مولکولها اهمیت داشته باشد و نه نوع آنها ، لذا میتوان انتظار داشت که ظرفیتهای گرمایی مولی مواد مختلف تقریبا به نحو یکسانی با دما تغییر کنند.
کلمات کلیدی: فیزیک حالت جامد
باروت مادهای است که بهسرعت میسوزد و از همین رو در سلاحهای گرم بهعنوان ماده پیشرانه بکار میرود.
باروت بر دو گونه اصلی است: باروت سیاه و باروت بی دود.
باروت سیاه نخستین نوع باروت بود. اختراع آن را در حدود قرنهای هفتم تا نهم میلادی به چینیها، مسلمانان (عربها، ایرانیان) و حتی به راجر بیکن (کیمیاگر انگلیسی سدهٔ سیزدهم میلادی) نسبت میدهند.
پیشینه
گاه اختراع باروت به چینی ها در سده دهم میلادی نسبت داده میشود و گاه ادعا میشود که «باروت حقیقی یک اختراع اروپایی متعلق به سده سیزدهم میلادی است.» در رسالهای از راجر بیکن (۱۲۴۲ یا ۱۲۴۸) آمده است: «ترکیب شوره و سولفور شعلهای درخشان و صدایی رعدآسا ایجاد میکند.» این اولین سند مکتوب درباره باروت در تاریخ غرب است.
قدمت کهنترین گزارش هایی که به کاربرد باروت در چین دلالت دارد به سال ۱۲۳۲ میلادی میرسد و این زمانی است که مغولان به مرکز ایالت هونان حمله بردند و مدافعین چینی از نوعی «نیزههای آتشین پرتاب شونده» و بمب های منفجرشونده استفاده کردند که مشخصات آن چندان روشن نیست. این فقرات گروهی از محققین را به این نتیجه رسانیده که چینی ها در آن زمان باروت را کشف کرده بودند.
در همین سده باروت در اروپا نیز پدیدار شد و شواهدی در دست است که نشان میدهد در سال ۱۲۴۱ مغولان در جنگ های اروپایی خود از آن استفاده میکردند.
پیشینه آشنایی مسلمانان با باروت و سلاح های آتشین به قبل از سده سیزدهم میلادی و به اندلس و شمال افریقا میرسد. مسلمانان اندلس در سده دوازدهم باروت را میشناختند و در سال ۱۱۱۸ در جنگ های شبه جزیره ایبری توپ و اسلحه آتشین به کار میبردند. ابن خلدون از کاربرد اسلحه آتشین در سده سیزدهم میلادی و در یکی از جنگ های ابویوسف، سلطان مراکش، در سال ۶۷۲ ق./ ۱۲۷۳ م. خبر میدهد: «و از انباری که با آتش و باروت بطور شگفت آوری مشتعل شده بود به دشمن آتش میافکند و قدرت خداوند از این عملیات هولناک ظاهر میگشت.» ممالیک مصر در مقابله با لشکرکشی صلیبی (۱۲۴۸ -۱۲۴۹) لویی نهم فرانسه (لویی قدیس) از توپ استفاده میکردند و به نوشته یک ناظر فرانسوی «هر بار که یک توپ در میرفت، پادشاه فرانسه متعجب میشد و فریاد میکرد: عیسای عزیز، من و افرادم را حفظ کن!» حسن الرماح (متوفی ۶۹۴ ق./ ۱۲۹۴ م.)، در کتاب فنون جنگی، فرمول باروت را بیان داشته و درباره توپ سخن رانده است. با ترجمه کتب عربی به لاتین اولین اطلاعات درباره باروت و کاربردهای نظامی آن به اروپا رسید و راجر بیکن با این ماده آشنا شد.
جرجی زیدان گفته است: «عرب ها [مسلمانان] پیش از دیگران استعمال باروت را میدانستند و اگر آن ها باروت را اختراع نکرده باشند، لااقل باروت توسط آن ها به مردم [اروپای] قرون وسطی منتقل شده است.” در دایرةالمعارف بریتانیکا در چاپ جدید آمده است: «باروت سیاه هرچند ریشه در چین سده دهم میلادی دارد… ولی شواهدی در دست است که نشان میدهد اعراب [مسلمانان] نخستین کسانی بودند که آن را تکامل بخشیدند و در سال ۱۳۰۴ اولین تفنگ ها را اختراع کردند.» و در مقاله دیگر چنین آمده است:
برخی گزارش ها حاکی از آن است که اعراب [مسلمانان] در سال ۱۲۴۹ در شبه جزیره ایبری از موشک استفاده میکردند و در سال ۱۲۸۸ با این سلاح به شهر والنسیا حمله بردند. در اوایل سده چهاردهم میلادی نیز مسلمانان اندلس در جنگ با صلیبیون از توپ استفاده میکردند. اسماعیل، امیر غرناطه، برای درهم شکستن حصار شهر هوسکار (۷۲۴ ق./ ۱۳۲۴ م.) از دستگاه بزرگی بهره جست که با باروت کار میکرد و گلوله هایی پرتاب مینمود که با صدای رعدآسا به قطعات کوچک تقسیم میشد و خرابی های بزرگ بر جای مینهاد. نوزده سال بعد مدافعین مسلمان یکی از شهرهای اندلس در برابر حمله صلیبیون از سلاحی مشابه استفاده میکردند که گلولههای آهنین پرتاب میکرد.
در سال ۱۲۴۸، یعنی تقریباً مقارن با همان زمان که راجر بیکن فرمول باروت را در رساله خود نوشت و “لویی قدیس” لشکرکشی صلیبی خود را به فلسطین آغاز کرد، فردیناند سوم، شاه کاستیل و لیون، از سلاح های آتشین در فتح سویل (اشبیلیه) استفاده نمود. این احتمالاً اولین استفاده نظامی از باروت به وسیله اروپاییان است.
کلمات کلیدی: فیزیک حالت جامد



.GIF)