* مطالب علمی *
ایساتیس
آقاشیر
.: شهر عشق :.
جملات زیبا
تعقل و تفکر
دکتر رحمت سخنی
بیگانه ، دختری در میان مردمان
تا ریشه هست، جوانه باید زد...
اس ام اس عاشقانه
خاطرات خاشعات
اس ام اس سرکاری اس ام اس خنده دار و اس ام اس طنز
وسوسه عقل
پرهیزکار عاشق است !
فروش و تعمیر موبایل در استان یزد
آموزش
وبلاگ تخصصی کامپیوتر
هک و ترفند
فروش و تعمیر موبایل در استان یزد
انجمن فیزیک پژوهش سرای بشرویه
عاشقان خدا فراری و گریزان به سوی عشق و حق®
وبلاگ عشق و محبت ( اقا افشین)
باید زیست
دست نوشته های دو میوه خوشمزه
در دل نهفته ها
روزگاران(حتما یه سری بهش بزن ضرر نمی کنی)
فقط برای ادد لیستم...سند تو ال
تجربه های مدیریت
سولات تخصصی امتحان دکترا دانشگاه آزاد
سولات تخصصی امتحان دکترا دانشگاه آزاد
ارزانترین و بزرگترین مرکز سوالات آزمون دکترا
عکس و اس ام اس عشقولانه
دانلود نرم افزار های روز دنیا
شاهرخ
مکانیک هوافضا اخترفیزیک
مکانیک ، هوافضا ،اخترفیزیک
وبلاگ تخصصی فیزیک و اختر فیزیک
وبلاگ تخصصی فیزیک جامدات
همه با هم برای از بین نرفتن فرهنگ ایرانی
انتخاب
فیزیک و واقعیت
ترجمه متون کوتاه انگلیسی
دنیای بیکران فیزیک
| اگر نوترون منفردی به یک قطعه ایزوتوپ 235U نفوذ کند، در اثربرخورد به هسته اتم 235U ، اورانیوم به دو قسمت شکسته میشود که اصطلاحا شکافت هستهای نامیده میشود. |

مقدمه
 |
انرژی شکافت هستهای
انرژی بستگی هستهای
از طرف دیگر M همیشه کمتر از مجموع جرمهای تشکیل دهندههای منزوی هسته است. این اختلاف به توسط فرمول انیشتین توضیح داده میشود که رابطه بین جرم و انرژی هم ارزی جرم و انرژی را برقرار میسازد. اگر یک دستگاه مادی دارای جرم باشد در این صورت دارای انرژی کلی E است. E = M C2 که در آن C سرعت نور در خلا و M جرم کل هسته مرکب از نوکلئونها و E مقدار انرژیی است که در اثر فروپاشی جرم M تولید میشود. بنابر این اصول انرژی هستهای بر آزاد سازی انرژی پیوندی هسته استوار است. هر سیستمی که دارای انرژی پیوندی بیشتر باشد پایدار میباشد. در واقع جرم مفقود شده در واکنشهای هستهای طبق فرمول E = M C2 به انرژی تبدیل میشود. پس انرژی بستگی اختلاف جرم هسته و جرم نوکلئونهای تشکیل دهنده آن است، که معرف کاری است که باید انجام شود تا نوکلئونها از هم جدا شوند.
 |
مواد شکافتنی
شکافت 235U
مقدمه کلی
آلایندهها بر حسب ترکیب شیمیاییشان ، به دو گروه آلی و معدنی تقسیم میشوند. ترکیبات آلی حاوی کربن و هیدروژن هستند. برخی از ذرات آلی که بیش از سایر ذرات آلی در اتمسفر یافت میشوند، عبارتند از: فنلها ، اسیدهای آلی و الکلها. معروفترین ذرات معدنی موجود در اتمسفر عبارتند از نیتراتها ، سولفاتها و فلزاتی مانند آهن ، سرب ، روی و وانادیم.
منابع آلایندهها
هوا دارای آلایندههای طبیعی نظیر هاگهای قارچها ، تخم گیاهان ، ذرات معلق نمک و دود و ذرات غبار حاصل از آتش جنگلها و فوران آتشفشانهاست. همچنین هوا حاوی گاز منوکسید کربن تولید شده به شکل طبیعی (CO) حاصل از تجزیه متان (CH4) و هیدروکربنها به شکل ترپنهای ناشی از درختان کاج ، سولفید هیدروژن (H2S) و متان (CH4) حاصل از تجزیه بیهوازی مواد آلی میباشد.
منابع آلایندهها را بطور کلی میتوان در چهار گروه اصلی طبقه بندی کرد: شامل وسائط نقلیه موتوری ، وسائط نقلیه هوایی ، ترنها ، کشتیها و هر نوع استفاده و یا تبخیر بنزین ، در بر گیرنده تامین انرژی و حرارت لازم برای مقاصد مسکونی ، تجاری و صنعتی ، نیروگاههای مولد برق که با نیروی بخار کار میکنند، مانند صنایع شیمیایی ، متالوژی ، تولید کاغذ و پالایشگاههای تصفیه نفت ، شامل زایدات ناشی از مصارف خانگی و تجاری ، زایدات زغال سنگ و خاکستر باقیمانده از سوزاندن بقایای کشاورزی.
هیدروکربنها
ترکیبات آلی که تنها دارای هیدروژن و کربن هستند، به نام هیدروکربن نام میگیرند که بطور کلی به دو گروه آلیفاتیک و آروماتیک تقسیم میشوند.
هیدروکربنهای آلیفاتیک
گروه هیدروکربنهای آلیفاتیک شامل آلکانها ، آلکنها و آلکینها هستند. آلکانها عبارتند از: هیدروکربنهای اشباع شده که در واکنشهای فتوشیمیایی اتمسفر نقش ندارند. آلکنها که معمولا به نام اولفینها خوانده میشوند، اشباع نشده هستند و در اتمسفر از لحاظ فتوشیمیایی تا حدودی فعالاند. این گروه در حضور نور خورشید با اکسید نیتروژن در غلظتهای زیاد واکنش نشان میدهند و آلایندههای ثانوی مانند پراکسی استیل نیترات (PAN) و ازن (O3) را بوجود میآورند. هیدروکربنهای آلیفاتیک تولید شده تا حدود (326mg/m3) برای سلامت انسان و جانوران خطرساز نیست.
هیدروکربنهای آروماتیک
هیدروکربنهای آروماتیک که از لحاظ بیوشیمیایی و بیولوژیکی فعال و برخی از آنها بالقوه سرطانزا هستند، یا از بنزن مشتق شدهاند و یا به آن مربوط میشوند. افزایش میزان ابتلا به سرطان ریه در نواحی شهری به هیدروکربنهای چند هستهای خارج شده از اگزوز اتومبیلها نسبت داده شده است. بنزوپیرین ، سرطانزاترین هیدروکربنهاست. بنزاسفنانتریلین ، بنزوانتراسین و کریزین هم مواد سرطانزای ضعیفاند.
منابع هیدروکربنها
میللنگها و کاربراتورها ، بیشترین درصد آزادسازی هیدروکربنها را به خود اختصاص دادهاند. تجهیزات سوزاننده مکمل که با کاتالیست کار میکنند، هیدروکربنها را آزاد کرده و منوکسید کربن را سوزانده و تولید CO2 و آب مینمایند.
تکنولوژی کنترل هیدروکربنهای متصاعد شده از منابع ساکن
تکنولوژی کنترل هیدروکربنهای متصاعد شده از منابع ساکن عبارتند از: خاکستر سازی ، جذب ، تراکم و جایگزین نمودن سایر مواد.
فرآیند خاکسترسازی با دستگاههای سوزاننده مکمل و دستگاههای سوزاننده مکمل کاتالیستی صورت میگیرد. جذب سطحی توسط کربن فعال صورت میگیرد و جذب هیدروکربنها بوسیله یک محلول شوینده در برجهای سینیدار ، شویندههای جت و برجهای آکنه ، برجهای پاشنده و شویندههای ونتوری صورت میگیرد.
منوکسید کربن
گاز منوکسید کربن ، بیرنگ ، بیمزه و بیبو است و در شرایط عادی از لحاظ شیمیایی بیاثر و طول عمر متوسط آن در اتمسفر حدود 2.5 ماه است. در حال حاضر مقدار منو اکسید کربن در اتمسفر بر روی اموال انسانی ، گیاهان و اشیا بیاثر یا کماثر است. در غلظتهای زیاد منو کسید کربن ، به علت تمایل زیاد به جذب هموگلوبین میتواند در متابولیسم تنفسی انسان بطور جدی اختلال ایجاد نماید.
غلظت منوکسید کربن در نواحی متراکم شهری که ترافیک سنگین و حرکت خودروها کند است، به میزان قابل توجهی افزایش مییابد. منابع کربن ، منوکسید کربن طبیعی و انسانی هستند. طبق گزارش آزمایشگاه ملی آرگون ، در اثر اکسیداسیون گاز متان حاصل از مرگ گیاهان سالانه 13.2 میلیون تن CO وارد طبیعت میشود. منبع دیگر تولید این ماده ، متابولیسم انسانی است بازدم شخصی که در حال استراحت است بطور تقریبی حاوی CO ، 1ppm است.
استانداردهای کنترل منوکسید کربن
آنگاه که مقدار منوکسید کربن در مدت زمان کوتاهی به حد مرگبار میرسد و شرایط اضطراری میشود، برای مقابله با چنین شرایطی که مقدار CO بطور متوسط در مدت زمان 8 ساعت به (46mg/m3 (40ppm میرسد،عملیات شدید کنترلی انجام میشوند که عبارتند از: متوقف ساختن کارخانههای صنعتی و مسدود نمودن جادههایی که در آنها معمولا ترافیک سنیگن وجود دارد. جذب سطحی ، جذب ، میعان و احتراق روشهای فنی کنترل CO هستند.
اکسیدهای گوگرد
این اکسیدها شامل 6 ترکیب مختلف گازی هستند: منوکسید سولفور (SO) ، دیاکسید سولفور (SO2) ، تریاکسید سولفور (SO) تترا اکسید سولفور (SO4) ، سکو اکسید سولفور (SO2) و هپتو اکسید سولفور (S2O7). در مطالعه آلودگی هوا ، دیاکسید سولفور و تریاکسید سولفور حائز بیشترین اهمیت است. با توجه به پایداری نسبی SO2 در اتمسفر این کار میتواند به عنوان یک عامل اکسید کننده و یا احیا کننده وارد عمل شود.
SO2 که با سایر اجزای موجود در اتمسفر به شکل فتوشیمیایی یا کاتالیستی وارد واکنش میشود، میتواند قطرات اسید سولفوریک (H2SO4) و نمکهای اسید سولفوریک را تولید بکند. SO2 با آب وارد واکنش شده ، تولید سولفورو اسید مینماید. این اسید ضعیف با بیش از 80% SO2 آزاد شده در اتمسفر ناشی از فعالیتهای انسانی به سوزاندن سوختهای جامد و فسیلی مربوط میشود.
استانداردهای کنترل اکسیدهای سولفور
روشهای گسترده جهت کنترل اکسید سولفور عبارتند از: بکارگیری سوختهای دارای گوگرد کمتر ، جداسازی گوگرد از سوخت ، جایگزین ساختن منابع انرژیزای دیگر ، تبدیل زغال سنگ به مایع یا گاز ، پاکسازی محصولات حاصل از احتراق.
اکسیدهای نیتروژن
شامل منوکسید نیتروژن (NO) ، دیاکسید نیتروژن (NO2) ، نیترو اکسید (N2O) نیتروژن سیسکواکسید (N2O3) ، نیتروژن تترااکسید (N2O4) و نیتروژن پنتواکسید (N2O5) هستند.
دو گاز مهمی در معادلات آلودگی هوا مهماند عبارتند از: اکسید نیتریک (NO) و دیاکسید نیتروژن ، دیاکسید نیتروژن که از هوا سنگینتر و در آب محلول است، در آب تشکیل اسید نیتریک و یا اسید نیترو و یا اکسید نیتریک (NO) میدهد. اسید نیتریک و اسید نیترو در اثر بارندگی به سطح زمین سقوط کرده ، یا با آمونیاک موجود در اتمسفر (NH3) ترکیب شده آمونیم نیترات (NH4NO3) بوجود میآورد.
در این مواقع 2NO از اجزای غذایی گیاهان را تشکیل میدهد. NO2 یکی از اجزای غذایی گیاهان را تشکیل میدهد. NO2 که در دامنه تشعشع فوقبنفش جاذب خوب انرژی به شمار میرود، در تولید آلایندههای ثانوی هوا از قبیل ازن O3 نقش مهمی دارد مقدار NO آزاد شده در اتمسفر به مراتب بیش از مقدار NO2 آزاد شده است. NO در فرآیندهای احتراقی با دمای زیاد و در اثر ترکیب نیتروژن و اکسیژن بوجود میآید.
منابع اکسیدهای نیتروژن
برخی از اکسیدهای نیتروژن به صورت طبیعی و برخی به صورت انسانی ایجاد میشوند. در اثر آتشسوزی جنگل مقدار اندکی NO2 ایجاد میشود. تجزیه باکتریایی مواد آلی نیز سبب آزاد شدن NO2 در اتمسفر میشود. در واقع منابع تولید کننده NO2 بطور طبیعی تقریبا 10 برابر منابع انسانی که در نواحی شهری دارای تراکم و غلظت هستند میباشد. بخش عمده NO2 تولید شده از منابع انسانی مربوط به احتراق سوخت در منابع ساکن و حرکت وسائط نقلیه میباشد.
استانداردهای کنترل اکسیدهای نیتروژن
بطور کلی اغلب اندازه گیریهای کنترلی برای NO2 آزاد شده در راستای محدود ساختن شرایط احتراق و کاهش تولید NO2 و همچنین استفاده از تجهیزات متنوع برای حذف NO2 از جریان گازهای خروجی انجام میشوند.
اکسید کنندههای فتوشیمیایی
اکسید کنندهها یا اکسید کنندههای کامل دو عبارتی هستند که برای توصیف مقادیر اکسید کنندههای فتوشیمیایی بکار میروند و معمولا نشاندهنده قدرت اکسید کنندگی هوای اتمسفر میباشند. ازن (O3) که اکسید کننده فتوشیمیایی اصلی است، در حدود 90 درصد از اکسید کنندهها را بخود اختصاص میدهد. سایر اکسید کنندههای فتوشیمیایی مهم در کنترل آلودگی هوا عبارتند از: اکسیژن نوزاد (O) ، اکسیژن مولکولی برانگیخته (O2) ، پروکسی آسیل نیترات (PAN) ، پروکسی پروپانول نیترات (PPN) ، پروکسی بوتیل نیترات (PBN) ، دی اکسید نیتروژن (NO2) ، پراکسید هیدروژن (H2O2) و الکیل نیتراتها.
اثرات اکسیدکنندهها
اثرات اکسیدکنندهها بر سلامتی انسان میتواند موجب سرفه ، کوتاهی نفس ، گرفتگی راه عبور هوا ، گرفنگی و درد قفسه سینه ، عملکرد نامناسب ششها ، تغییر سلولهای قرمز خون ، آماس خشک و سوزش چشم ، بینی و گلو شوند. اکسید کنندههای اصلی که به گیاهان آسیب میرسانند، عبارتند از PAN , O3 که از خلال روزنههای موجود در برگ وارد گیاه شده و در متابولیسم سلول گیاهی دخالت میکنند. علائم بوجود آمده از تماس گیاه با PAN عبارتند از: برونزه شدن ، براق شدن و نقرهای شده سطح زیرین برگها.
تماس متناوب اکسید کنندهها با گیاهان موجب کاهش محصولات میشود. اکسید کنندهها به سرعت با رنگها ، الاستومرها (اکسید کنندهها) الیاف پارچهای و رنگهای نساجی واکنش نشان داده ، آنها را اکسید میکند.
استانداردهای کنترل اکسید کنندهها
این نکته روشن شده است که حتی اگر هیچ هیدروکربنی در اتمسفر وجود نداشته باشد، تا زمانی که CO و NO2 حضور دارند، مقادیر قابل ملاحظهای از ازن میتواند تولید شود. در حال حاضر علیرغم کوششهای منظم بر روی کنترل CO ، هیدروکربنها و NO2 مقادیری از این آلایندهها که برای ایجاد ازن فتوشیمیایی کافی هستند، همچنان در اتمسفر وجود دارد.
کلمات کلیدی: هسته ای، هواشناسی و اختر فیزیک
بیتوجهی بشر به طبیعت
بشر ، این هوشمند کیهان ، با پیشرفتهای علمی و متمدن شدن ، به طبیعت آسیب میرساند. گیاهان و درختان را به دلایل مختلف از بین میبرد، فاضلابهای خانگی و صنعتی را به رودها و دریاها میریزد، کارخانهها و ماشینها و ... هوا را آلوده میکند و موارد بیشماری از این قبیل. بشر متمدن و دستاوردهایش علاوه بر اینکه آب و خاک و هوای زمین را آلوده کردهاند، پا را فراتر نهاده و فضا را هم آلوده نمودهاند. |
زبالههای فضایی
ما هزاران شی را در فضا جا دادهایم. این اشیاء شامل ماهوارههایی است که دور زمین میگردند و اطلاعات را به زمین ارسال میکنند. ماهوارههایی هم وجود دارند که کار آنها متوقف شده ولی هنوز در فضا سیر میکنند. برخی ماهوارهها منفجر شده یا با همدیگر تصادم کردهاند و در هر بار که این اتفاق افتاده به قطعات کوچکی تقسیم شدهاند. در واقع ، ایالات متحده آمریکا در نظر داشته است که برخی از این ماهوارههای از کار افتاده را برای آزمایش تجهیزات پروژه جنگ ستارگان منهدم کند.فقط ماهوارهها نیستند که در فضا وجود دارند، ماهوارهها را موشک به فضا برده است لذا قطعات موشکی نیز در فضا وجود دارند. با پرتاب هر موشک به فضا مقدار بیشتری زباله در مدار زمین جمع میشود و این امر خطر برخورد فضاپیماها را به همدیگر در آینده بیشتر میکند.
گردش زبالهها در فضا
زبالههای مدار نزدیک زمین مجددا به جو زمین بر میگردند، تکههای کوچکتر میسوزند و تکههای بزرگتر همانند ایستگاه فضایی SK lob در سال 1979 ، در زمین فرود میآیند. در فاصلههای دورتر از زمین ، زبالهها برای سالها در مدار باقی میمانند، ولی بطور بیحرکت. اگر این اشیا نسبت به زمین بیحرکت میماندند، حضورشان در فضا هیچ خطر مهمی در بر نداشت. چون حجم فضا واقعا بزرگ است و جای کافی برای این اشیا دارد.ولی اگر آنها بیحرکت میبودند، به زمین میافتادند. این اشیا در فضا ماندهاند. چرا که با سرعتهایی تا 8 کیلومتر در ثانیه حول زمین میگردند. با این سرعتها هر شی در فضا به منزله یک گلوله است و در بیشتر موارد ، خطرناکتر از گلولهای است که از تفنگ شلیک میکنیم. هر بار که ماهوارهای منهدم میشود، در حدود یک هزار قطعه حجیم بوجود میآید که همه آنها به دور زمین میگردند.
 |
خطرات زبالههای فضایی
حدود 7000 جرم آسمانی در حال گردش در فضا هستند که بدلیل بزرگی بوسیله رادار ردیابی شدهاند. از این تعداد تنها حدود 400 مورد را ماهوارههای فعال تشکیل میدهند. تکههای زیادی از زبالهها هم وجود دارند که آنقدر کوچک هستند که قابل ردیابی نیستند. اما همین تکهها برای ایجاد خطر به اندازه کافی بزرگ هستند و قادرند به فضاپیما آسیب برسانند. همچنین میلیونها قطعه ریزتر نیز وجود دارند که شناسایی نشدهاند. وجود این اشیا ناچیز هم نگران کننده است. چرا که با سرعت چند کیلومتر در ثانیه حرکت میکنند.در ژوئن سال 1983 ، یک ریزه ماده به اندازه
 اینچ (کوچکتر از آنکه بتوان دید) به پنجره شاتل فضایی چلنجر برخورد کرد. در این آتصادم تکهای از شیشه کنده شد و سوراخ کوچکی به قطر یک دهم اینچ در پنجره بر جای ماند. شاید این واقعه چندان مهم به نظر نیاید ولی این سوراخ پنجره را چنان معیوب کرد که لازم شد پیش از پرواز مجدد شاتل ، با هزینه 50000 دلار پنجره را تعویض کنند. اگر شی بزرگتری با شاتل برخور میکرد، شاید فاجعه چلنجر 2.5 سال زودتر از انفجاری که هفت سرنشین آن را کشت، پیش میآمد.
اینچ (کوچکتر از آنکه بتوان دید) به پنجره شاتل فضایی چلنجر برخورد کرد. در این آتصادم تکهای از شیشه کنده شد و سوراخ کوچکی به قطر یک دهم اینچ در پنجره بر جای ماند. شاید این واقعه چندان مهم به نظر نیاید ولی این سوراخ پنجره را چنان معیوب کرد که لازم شد پیش از پرواز مجدد شاتل ، با هزینه 50000 دلار پنجره را تعویض کنند. اگر شی بزرگتری با شاتل برخور میکرد، شاید فاجعه چلنجر 2.5 سال زودتر از انفجاری که هفت سرنشین آن را کشت، پیش میآمد. گسترش آلودگی فضا
آلودگی فضا و زبالههای فضایی روز به روز بیشتر میشود. آمریکا ، روسیه و کشورهای دیگر پرتاب اشیا به فضا را ادامه میدهند. قطعات معلق در فضا بطور مداوم افزایش مییابد و این امر وقوع انفجارها و تصادمات بیشتری را ممکن میسازد. اگر قطعه معلق به جای بسیار مهمی از ماهواره برخورد کند، شاید ماهواره کاملا از کار بیافتد. لذا باید به منظور بالا بردن دوام ماهوارهها را مستحکمتر ساخت. این یعنی استفاده از مواد بیشتر در ساخت ماهوارهها و بکاربردن هزینه مضاعف در پرتاب آنها.برخی تخمین میزنند که تعداد قطعات زباله در فضا هر ده سال چهار برابر میشود. یعنی با این روال شاید روزی فرا رسد که فضا چنان آکنده از این قطعات باشد که پروازهای فضایی از میان انبوه زبالههای فضای پیرامون زمین ، با احتمال خطرات فراوان صورت گیرد.
چه باید کرد؟
- آیا باید تعداد ماهوارههای پرتابی را کاهش دهیم تا پیشگیری قبل از درمان کرده باشیم؟
- آیا میتوانیم برای جلوگیری از انفجارها و برخوردها اقداماتی انجام دهیم؟
- آیا میتوانیم اشیاء معلق در فضا را متوقف کنیم؟
- حتی اگر پاسخ سوالات فوق مثبت باشد، خطر کاملا برطرف نمیشود بلکه فقط افزایش آن کند میشود. بهترین چاره این است که به فکر روشی برای پاک کردن مداوم فضا باشیم. به عبارت دیگر ، باید فضا را با جارو برقی تمیز کنیم!
- آیا امکان ایجاد چنین سیستمی وجود دارد؟
کلمات کلیدی: هواشناسی و اختر فیزیک
!نگاه اجمالی
حتماً تا کنون درباره DVD یا CD و یا جراحی چشم با لیزر و غیره چیزهایی شنیدهاید و حتما این بزرگترین اختراع علوم را تا کنون به عناوین مختلف استفاده کردهاید؛ بدون آنکه از خودتان سؤال کرده باشید که مخترع لیزر چه کسی بوده است. آیا میدانید که مخترع لیزر یک ایرانی بوده است؟ اولین نوع لیزر ؛ لیزر گازی بود (که در سیستم درمانی و صنایع بطور گسترده بکار برده میشود) که توسط آقای علی جوان متخصص فیزیک اختراع شد.
 |
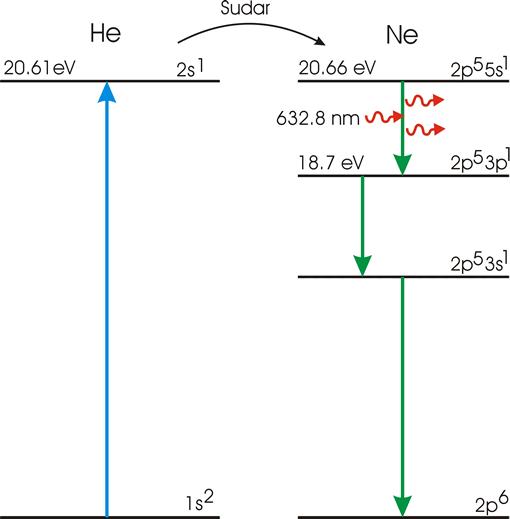
لیزر هلیوم _ نئون اولین لیزری بود که در دسامبر 1960 با خروجی 1.15 میکرومتر بطور پیوسته عمل کرد. عمل برانگیختگی در این لیزر از طریق تخلیه الکتریکی ، در مخلوط از هلیوم و نئون انجام میشد. از آن زمان انواع زیادی از لیزرهای گازی در گستره وسیعی از طول موج از 100 نانومتر فرابنفش خلا تا فروسرخ دور یا حتی امواج میلیمتری ، تولید شدهاند. بیش از 5000 خط لیزری شناسایی شدهاند. در بیشتر موارد گاز بوسیله تخلیه الکتریکی یا دمش اپتیکی ، به یاری ساز و کارها و روشهای متعددی برانگیخته میشود.
گزیدهای از سخنان پروفسور علی جوان در مورد اختراع لیزر
در دنیای علمی و علوم ، این مثل همیشه گفته میشود که وقتی که زمان برای یک اختراع یا یک کشف درست شده و شما آنرا انجام ندهید، کس دیگری انجام خواهد داد. این مثل تا حد زیادی حقیقت دارد، اما همیشه اینطور نیست. بعضی وقتها آدمها یک فکر خوب را از دست میدهند. وقتی که نوبت برسد به لیزر ، لیزر گازی ، میتوانست در سال 1930 اختراع شده باشد، نه پس از سی سال در سال 1960 که من آنرا اختراع کردم. اگر شما به تاریخ علم نگاه کرده باشید، مخصوصا به فیزیکدانان اروپایی ، آنها به اختراع لیزر در سالهای 1937 و 1938 خیلی نزدیک شده بودند.
دانشمندان در حال مطالعه بر روی اتمها بودند، که چگونه امواج نوری را بیرون بدهند (تقویت نور در گازها بوسیله گسیل القائی پرتوافکنی) و آنها به اختراع لیزر خیلی نزدیک شده بودند. از نوشتجات آنها شما میتوانید ببینید که آنها به راه درست رفته بودند، اما بعدا راه را اشتباه رفته و از مسیر اصلی منحرف شدند. اگر من در همان سالها بودم مطمعنا آنرا اختراع میکردم، مبالغه نمیکنم و میدانم که آنرا انجام میدادم.
 |
|
مجله "Smithsonian" آوریل 1971. |
من میدانم که این دانشمندان چرا آنرا از دست دادند؛ آنها عمیقا درگیر با داراییهای موضوع در تعادل گرمایی بودند. با این وجود در لیزرها ، اتمها باید در یک حالت تعادل غیر گرمایی باشند؛ که این قدری پیچیده میشود و از حوصله این بحث خارج است. البته تمام آنها اکنون تمام شده است، ولی آن دانشمندان پیشروان این راه بودهاند. موقعی که من نظریهام را در رابطه با لیزر گازی دادم، بعضی از قسمتهای آنرا ، نه تمام آن ، بر اساس گرفتاری من در کارهایی بود که مشغول انجام آن بودم. اما من میدانستم که بالاخره این لیزر گازی را میتوانم اختراع کنم، در غیر اینصورت اصلا دنبال آن کار را نمیگرفتم.
کسانی که از همان ابتدا نظر من را میدانستند، خیلی به آن بدبین بودند. حتی آنهایی که در تیم من بودند و با من کار میکرند، در این رابطه شک داشتند. من این شک را در بسیاری از آنها دیدهام. حتی فیزیکدانان خوب هم بعضی وقتها در عقاید خودشان نامطمئن هستند و آنها با تردید منزلزل میشوند.
تفاوت لیزر گازی با جامدات
استفاده از گازها به عنوان ماده فعال لیزری تفاوت جالبی با جامدات دارد. به دلیل آنکه جمعیت معکوسی که میتوان در گازها بدست آورد، خیلی کمتر از جامدات است، یک میله Nd-YAG تقریبا 6X1025 اتم Nd در مترمکعب دارد، ولی در لیزر He_Ne فقط 1021 اتم Ne در هر مترمکعب وجود دارد. بنابراین انتظار داریم که لیزرهای گازی پرقدرت خیلی حجیم و بزرگ باشند. از سوی دیگر ، گازها بسیار یکنواختتر و همگنتر از جامدات هستند و میتوان برای خنک کردن و دوباره پر کردن آنها را در یک مدار بسته به حرکت در آورد.
 |
تئوری لیزر گازی
برای گازها بطور کلی پهن شدگی ترازهای انرژی نسبتا کوچک است (در مرتبه چند گیگا هرتز یا کمتر) چون ساز و کارهای پهن شدگی خط ضعیفتر از جامدات است، برای گازهایی در فشار پایین (چند تور) که اغلب در لیزرها بکار میروند، پهن شدگی القا شده در اثر برخورد خیلی کوچک است و بنابراین پهناهای خط اساسا با پهن شدگی دوپلری تعیین میشوند. بدین دلیل دمش اپتیکی با لامپهای بکار رفته برای لیزر حالت جامد ، در مورد گازها انجام نمیشود.
این لامپها زیاد کارآیی ندارند، چون طیف گسیلشان کم و بیش پیوسته است. در حالی که در محیط فعال هیچ نوار جذب پهنی وجود ندارد. تنها موردی که عمل لیزر در گاز بوسیله این نوع دمش اپتیکی حاصل شده است، دمش Gs با لامپ حاوی He است. در این مورد وضعیت برای دمش اپتیکی کاملا مناسب است، چون برخی از خطوط گسیل He منطبق بر خطوط جذب Cs هستند، ولی اهمیت این لیزر بیشتر از جنبه تاریخی آن است.
مکانیزم لیزرهای گازی
لیزرهای گازی معمولا با ابزارهای الکتریکی برانگیخته میشوند، یعنی دمش با عبور جریان به اندازه کافی قوی (dc یا تپی) از گاز انجام میشود. ساز و کارهای اصلی دمشی که در لیزرهای گازی صورت میگیرد، با عبور جریان الکتریکی مناسبی از گاز حاصل میشود. یونها و الکترونهای آزاد بوجود میآیند و چون این ذرات در اثر میدان الکتریکی شتابدار میشوند، انرژی جنبشی اضافی بدست میآورند و میتوانند با برخورد و به اتمهای خنثی آنها را برانگیخته کنند. دمش الکتریکی گاز معمولا با یکی از دو فرآیند زیر انجام میگیرد:
-
در گازی که تنها شامل یک گونه باشد، برانگیختگی فقط با برخورد الکترونی ایجاد میشود.
-
گازی که شامل دو گونه باشد (مثلا نوع A و نوع B) در اثر برخورد بین اتمهای دو نوع گاز نیز برانگیختگی ایجاد میشود.
 |
|
|
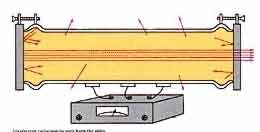
ساختار یک لیزر گازی
از آنجایی که اتمها خطوط جذبی بسیار باریکی در گازها دارند، تقریبا غیر ممکن است که بتوان به کمک تحریک (دمش) نوری در آنها جمعیت معکوس ایجاد نمود و به جای آن معمولا از روش تخلیه الکتریکی استفاده میشود. یک طرح شماتیک لیزر گازی با فشار کم مانند لیزر هلیوم _ نئون که در آن گاز تحت فشار تقریبا کم ، داخل لوله تخلیه با آند و کاتد در دو طرف آن قرار دارد. اگر آینههای تشدید کننده خارج از لوله تخلیه باشند، پنجرههای بروستر در دو انتهای لوله قرار میگیرند تا اتلاف در اثر بازتاب را کاهش دهند، این عمل البته باعث پلاریزه شدن نور خروجی میشود.
ولتاژ چندین کیلوولت در سرتاسر لوله اعمال میشود تا تخلیه الکتریکی انجام شود. در بعضی موارد گاز ممکن است قبلا کمی یونیزه شود. این عمل به کمک پالس ولتاژ بالا که به یکی از الکترودها اعمال شود و یا یک سیم کوتاهی که به دور لوله پیچیده شود، انجام میگیرد. در این روش تخلیه الکتریکی هم الکترونها و هم یونها و هم اتمهای خنثی وجود دارند. الکترونهای آزاد توسط میدان الکتریکی در تخلیه شتاب میگیرند و به سمت آند حرکت میکنند و اگر در بین راه به اتمها و یونها برخورد کنند، مقداری و یا همه انرژی خود را از دست میدهند و آن را به تراز بالای لیزری دمش میکنند.
طبقه بندی مواد لیزر گازی
-
لیزرهای یونی : در اتم یونیده ، مقیاس ترازهای انرژی گسترده میشوند و در اولین برخورد اتم خنثی را یونیزه میکنند.
-
لیزرهای اگزیمر : کلمه اگزیمر از عبارت « دیمر تحریک شده » بدست آمده است، یعنی یک مولکول دو اتمی وقتی در حالت تحریکی واقع است، پایدار است و در حالت پایه ، ناپایدار است.
طبقه بندی روش برانگیختگی لیزر گازی
مقدمه
لیزر این نور شگفت از نظر ماهیت هیچ تفاوتی با نور عادی ندارد و خواص فیزیکی لیزر ، آنرا از نورهای ایجاد شده از سایر منابع متمایز میسازد. از نخستین روزهای تکنولوژی لیزر ، به خواص مشخصه آن پی برده شد. و ما بصورتی گزینشی به این خواص از ماهیت فرآیند لیزر میپردازیم که خود این خواص بستری عظیم برای کاربردهای وسیع این پدیده ، در علوم مختلف بخصوص صنعت و پزشکی و ... ایجاد کرده است. به جرأت میتوان گفت پیشرفت علوم بدون تکنولوژی لیزر امکان پذیر نیست. |
پهنای باریکه
از آنجا که نشر القایی ، فوتونهایی را با راستای انتشار دقیقا یکسان تولید میکند، استفاده از پیکربندی آینه انتهایی به تقویت گزینشی باریکه محوری که تنها قطری در حدود 1mm دارد منجر میشود. بدین ترتیب لیزر ، باریکهای نازک و اساس موازی از نور را که معمولا دارای توزیع گاوسی از شدت است، از آینه خروجی به بیرون منتشر میکند. زاویه واگرایی باریکه لیزر مقداری در حدود 1mrad است، که در فاصله یک کیلومتری ، تنها قسمتی به عرض یک متر را روشن میکند.هر چند که میزان واگرایی باریکه در وهله نخست توسط حد پراش روزنه خروجی تعیین می ود، ولی به ازا اپتیکی مناسب می توان همین واگرایی اندک را به مقدار زیادی تصحیح کرد. شدت زیاد، خاصیتی است که بیش از سایر موارد همراه نور لیزر است و در حقیقت لیزرها بالاترین شدتهای روی زمین ایجاد میکنند. از آنجا که لیزر باریکهای اصولا موازی از نور را نه در تمام جهتها بلکه در راستای مشخصی نشر میکند، مناسبترین معیار شدت ، تابیدگی است. توان: انرژی در واحد زمان.
در این اینجا منظور از توان ، توان خروجی لیزر است، نه توان ورودی به آن. با متمرکز کردن باریکه تا رسیدن به حد پراش ناشی از ابزار اپتیکی متمرکز کننده میتوان تابیدگی را افزایش داد. به عنوان یک اصل کلی ، حداقل شعاع باریکه متمرکز شده قابل قیاس با طول موج میباشد. خروجی لیزرها که دارای یک توزیع گوسی از شدت میباشد، ماکزیمم شدت (قله یا پیک) تنها برای زمان بسیار کوتاهی قابل حصول است. و این شدت ماکزیمم (پیک) حاصل از یک لیزر تپی بطور وارون با مدت تپ متناسب است، روشها گوناگونی برای کاستن از طول تپ وجود دارد تا شدت آن افزایش یابد.
 |
همدوسی
همدوسی خاصیتی است که به بهترین وجه نور لیزر را از سایر انواع نور متمایز میکند و باز هم این خاصیت ، نتیجه ماهیت فرآیند نشر القایی است. نور حاصل از منابع معمولی که توسط نشر خود به خودی کار میکنند، به نور غیر همدوس آشفته موسم است. در این موارد ، هیچ همبستگی بین فاز فوتونهای گوناگون وجود ندارد و در اثر تداخلهای اساسا تصادفی بین آنها ، افت و خیز محسوسی در شدت پدید میآید. در مقابل در لیزر ، فوتونهایی که توسط محیط برانگیخته لیزر نشر میشوند، با سایر فوتونهای موجود در حفره ، همفازند.مقیاس زمانی که طی آن همبستگی فاز برقرار میماند، به عنوان زمان همدوسی شناخته میشود. بنابراین دو نقطه در طول باریکه لیزر به فاصلهای کمتر از طول همدوسی ، باید فاز مرتبطی داشته باشند. طول همدوسی برای انواع مختلف لیزر متفاوت است. مهمترین کاربرد همدوسی لیزری تمام نگاری (هولوگرافی) است، که روش برای تهیه تصاویر سه بعدی به شمار می رود.
تکفامی
مشخصه بارز نور لیزر و خاصیتی که بیشترین ارتباط را با کاربردهای شیمیایی دارد، تکفامی اساسی آن است. این خاصیت از این حقیقت منشأ میگیرند که تمام فوتونها در اثر گذار بین دو تراز انرژی اتمی یا مولکولی مشابه ، نشر میشوند و بنابراین تقریبا فرکانسهای دقیقا یکسانی دارند. تعداد کمی از فرکانسها با فواصل اندک از یکدیگر ، ممکن است در عمل لیزر حضور داشته باشند، بطورری که برای رسیدن به تکفامی بهینه باید وسیله اضافی دیگری را برای گزینش فرکانس لیزر تعبیه کرد. معمولا برای این کار از یک نسخه استفاده میشود که عنصری اپتیکی است که درون حفره لیزر قرار میگیرد و به گونهای تنظیم میشود، که تنها یک طول موج معین بتواند بین دو آینه انتهایی ، بطور نامتناهی به جلو و عقب حرکت کند. |



.GIF)






