آشکارساز تناسبی نوعی آشکارساز گازی با دو الکترود ، یکی استوانه و یکی سیمی در راستای محور استوانه است. وقتی آشکارساز در ناحیهای (ازلحاظ ولتاژ بین الکترودها) کار کند که در آن شماره یونهای ایجاد شده ، متناسب با انرژی اشعه باشد. در این صورت آشکارساز تناسبی نام دارد. ولتاژ اعمال شده در این آشکارساز بیشتر از ولتاژ اعمال شده در اتاقک یونیزاسیون میباشد که ولتاژ اعمال شده بین دو الکترود به اندازهای بزرگ است که الکترون یونش یافته یک اتم انرژی کافی درحرکت به سوی الکترود آند بدست میآورد و انرژی الکترون به اندازهای است که موجب یونش اتمهایی در مسیر خود میشود.
مشخصات و طرز کار آشکارساز تناسبی
آشکارساز تناسبی از یک الکترود سیلندری و یک رشته سیم مرکزی که معمولا از تنگستن میباشد، ساخته میشوند. به دلیل وضع هندسی دستگاه میدان الکتریکی در فاصله x از سیم برابر است با (E=V/xLn(b/a که درآن V ولتاژ وصل شده بین الکترودها و a و b به ترتیب شعاعهای سیم و الکترود خارجی میباشند. میدان الکتریکی در نزدیک رشته سیم خیلی بزرگتر است و با فاصله از سیم نسبت عکس دارد. بنابراین بیشترین تکثیر در نزدیکی سیم مرکزی انجام میپذیرد. حدود نصف از زوجهای یون در فاصلهای برابر با متوسط طول آزاد و 99% زوجهای یون در هفت برابر متوسط طول آزاد از الکترود مرکزی تشکیل میگردند. زمان جمع آوری الکترونها خیلی کوچک است. به هرحال چون الکترونها خیلی نزدیک به الکترود مرکزی ایجاد میشوند، v? مربوط به جمع آوری الکترون در الکترود مرکزی خیلی کوچک میباشد.
بنابراین سهم بیشتر سقوط پتانسیل مربوط به یونهای مثبت است. وجود این که یونهای مثبت کندتر از الکترونها هستند، پس از عبور مسافت کمی از سیم مرکزی بیشترین سقوط پتانسیل را درفاصله زمانی کوتاه بوجود میآورند. درنتیجه ، پالس مربوط به رسیدن یک زوج یون ابتدا خیلی سریع و سپس به کندی صعود مینماید. گاهی اوقات وقتی محل تشکیل هر یک از یونها نسبت به الکترود مرکزی متفاوت باشد، زمان تشکیل پالسها نامشخص خواهدبود. در چنین حالتی زمان لازم برای الکترونهای مختلف در رسیدن به ناحیه تکثیر یکسان نخواهد بود. تقویت کنندههای مرحله اول یونها را جمع آوری میکنند تا این نامعلومی را کاهش دهند.
زمان تفکیک
در آشکارساز تناسبی ، یونیزاسیون محدود به ناحیه اطراف مسیر اشعه میباشد. فرض کنیم که تابش 1 در زمان t1 وارد شمارنده میشود و تابش مشابه 2 در یک ناحیه دیگر در زمان t2 وارد آشکارساز میشود. در الکترود جمع کننده سقوط پتانسیل خواهیم داشت. اگر تقویت کننده دستگاه آشکارساز بتواند این تغیییر ولتاژ را به عنوان دو علامت الکتریکی تشخیص دهد و اگر این کمترین زمان جدایی باشد که این تشخیص امکانپذیر میگردد، در این صورت t2-t1 زمان تفکیک (Resolving time) برای آشکارساز تناسبی است. بنابراین زمان تفکیک (T) تابع سیستم الکتریکی است.
اگر زمان تفکیک صفر باشد، تغییر تعداد شمارش برحسب تغییر تعداد تابش باید یک خط مستقیم باشد. به هرحال اگر زمان تفکیک بینهایت باشد، این منحنی در سیستم مختصات y-x به محور x متمایل شده و بالاخره آن را قطع خواهد نمود. یعنی وقتی تعداد تابشهایی که وارد آشکارساز میشوند افزایش یابد، تعداد شمارش ثبت شده ابتدا افزایش مییابد و بعد از رسیدن به یک ماکزیمم به طرف صفر میل میکند. در این میزان شمارش صفر ، ولتاژ الکترود جمع کننده ثابت میماند. زیرا که میزان جمع آوری یونها برابر میزان نشت یونها خواهد بود.
آشکارساز تناسبی حساس نسبت به محل ورود اشعه
یکی از تفاوتهای اساسی بین آشکارساز تناسبی و آشکارساز گایگر مولر این است که در آشکارساز تناسبی ، یونیزاسیون محدود به ناحیه کوچکی در اطراف مسیر ذره تابشی است. در صورتی که در آشکارساز گایگر یونیزاسیون در تمام حجم آشکارساز انجام میشود. بنابراین در آشکارسازهای تناسبی ، امکان این که اطلاعاتی در مورد محل اشعه تابشی بدست آوریم، وجود دارد. در این نوع از آشکارسازها ، آند از یک سیم با مقاومت زیاد (معمولا رشته کوارتز با پوششی از کربن) تشکیل میشود. فرض کنیم ذره تابشی در وضعیت x یونهایی در مجاورت آند ایجاد مینماید. این یونها بوسیله آند جمع آوری شده و باعث جاری شدن جریان در دو جهت در طول آند خواهد شد. مقدار جریانی که از هر جهت جاری میشود تابع مقاومت در مسیر میباشد. به دلیل تفاوت جریان در دو انتهای آند پالسهای ایجاد شده در دو انتهای آند در ارتفاع و زمان صعود متفاوت خواهند بود. تفاوت در زمان صعود ، به دلیل تفاوت در ثابت زمانی ، معمولا برای بدست آوردن اطلاعات درباره محل اشعه بکار میرود.
شمارش نوترون با آشکارساز تناسبی
علاوه بر اینکه میتوان از آشکارساز تناسبی برای آشکارسازی ذرات آلفا و بتا استفاده نمود. این آشکارساز میتواند در آشکارسازی نوترونها نیز مورد استفاده قرار گیرند. یک آشکارساز واقعی نوترون معمولا گاز BF خالص و یا مخلوطی از BF3 و یکی از گازهای استاندارد آشکارسازهای گازی ، میباشد. وقتی که نوترون حرارتی بوسیله هسته جذب میشود، دو ذره یونیزه کننده قوی یکی ذره آلفا و دیگری هسته لیتیم که در جهت مخالف حرکت ذره آلفا حرکت میکند، رها میشوند. پالسهای ایجاد شده بوسیله محصولات واکنش هستهای در مقایسه با پالسهای بوجود آمده بسیله تابشهای نظیر اشعه گاما ، دارای ارتفاع نسبتا بزرگ است.
رابطه ارتفاع پالس با نوع ذره
نکتهای که وجود دارد رابطه ارتفاع پالس و نوع ذره است. ارتفاع پالسهای ایجاد شده با ذرات یونیزه کننده سنگین مانند ذرات آلفا ، ممکن است بطور قابل ملاحظهای از پالسهای بوجود آمده بوسیله الکترونهای با انرژی برابر ، متفاوت باشد. این اختلاف تابع نوع اشعه است که معمولا برای آشکارسازهای گازی ، کوچک میباشد. در مورد آشکارسازهای تناسبی و یونیزاسیون و آشکارساز نیم رسانا این حالت وجود دارد.
کلمات کلیدی: هسته ای
در سال 1923، دوبروی با الهام از مقایسه اصل فرما در اپتیک و اصل کمترین عمل در مکانیک ، بر آن شد که پیشنهاد کند طبیعت دوگانه موجی _ ذرهای تابش باید قرینهای در طبیعت دوگانه ذرهای _ موجی ماده داشته باشد (دوگانگی موج و ذره). بنابراین ذرات باید تحت شرایطی خاص ، خصوصیت موجی داشته باشند. همچنین دوبروی عبارتی برای طول موج منسوب به ذره پیشنهاد کرد که این طول موج با اندازه حرکت ذره نسبت مستقیم دارد و به وسیله ثابت پلانک این رابطه تناسب به تساوی تبدیل میشود:
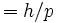
مشاهده آزمایشگاهی پراش الکترون نخستین بار در سال 1897-1276 توسط دیوسیون و گرومر به عمل آمد. این دو دریافتند که در پراکندگی الکترونها از سطح یک کریستال ، در راستاهای به خصوصی پراکندگی بیشتری وجود دارد.
از بلور شناسی میدانیم که بلورها دارای ساختار تناوبی هستند و میتوان صفحاتی موازی در نظر گرفت که یونها در روی آنها قرار گرفتهاند. بنابراین وقتی که یک موجی بر سطح بلور بتابد، این صفحات نقش پراکننده را بازی میکند. بنابراین فرض کنید که الکترونها بر سطح کریستال بتابند، بعضی از الکترونها توسط صفحات رویی پراکنده میشوند، در صورتی که برخی دیگر از صفحات اول عبور کرده و توسط صفحات داخلی پراکنده میشوند. لذا الکترونهای پراکنده شده به دلیل اختلاف مسیری که طی میکنند، دارای یک اختلاف فازی خواهند بود.
بنابراین اگر این الکترونهای پراکنده شده توسط یک آشکارساز ثبت شوند، الگوهای تداخلی حاصل میشوند. یعنی در نقاطی که الکترونها یا به عبارت دیگر ، امواج پراکنده شده تداخل سازنده داشته باشند، (اختلاف فاز آنها ضرب صحیحی از 2π باشد)، همدیگر را تقویت میکنند و در نقاطی که تداخل ویرانگر داشته باشند، نقش همدیگر را تضعیف میکند.
الگوی تداخلی پراکندگی الکترون را که توسط دیوسیون و گرومر مشاهده شده است، میتوان با ترسیم شماتیکی هندسه پراکندگی الکترون و محاسبه طول موج امواجی که با هم تداخل سازنده انجام میدهند و با بکار بردن رابطه دوبروی به صورت عملی استفاده نمود.
در این حالت فرض میکنیم که صفحات موازی داخل بلور به فاصله a از یکدیگر قرار گرفتهاند. بنابراین موجی را در نظر میگیریم که تحت زاویه ө نسبت به صفحه اول بر سطح آن فرود آید. قسمتی از این موج پراکنده شده و قسمت دیگری از آن عبور میکند. این قسمت عبور کرده ، دوباره از صفحه دوم پراکنده میشود.
اگر اختلاف مسیر این دو باریکه موجی پراکنده را محاسبه کنیم، برابر 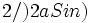 خواهد بود که در این رابطه λ طول موج است. برای این که تداخل سازنده باشد، باید اختلاف مسیر یا به بیان دیگر ، اختلاف فاز اشاره شده برابر 2nπ باشد، به عبارت دیگر باید داشته باشیم:
خواهد بود که در این رابطه λ طول موج است. برای این که تداخل سازنده باشد، باید اختلاف مسیر یا به بیان دیگر ، اختلاف فاز اشاره شده برابر 2nπ باشد، به عبارت دیگر باید داشته باشیم:
بعد از اینکه آزمایش پراش الکترون با موفقیت انجام شد، آزمایش پراش ذرات با باریکههای مولکولی هیدروژن و هلیم و با نوترون آهسته که بر خلاف ذرات دیگر ذرهای بدون بار است، انجام گرفت. پراش نوترون به ویژه در مطالعه ساختاری بلوری مفید است. لازم به ذکر است که برای انجام پراش باید حدود تقریبی انرژی ذرات با فواصل بلوری که از مرتبه آنگستروم است، قابل مقایسه باشد و به همین دلیل در عبارت بالا لفظ نوترون آهسته را بکار بردیم.
در مقیاس ماکروسکوپی ، مشاهده جنبههای موجی ذرات از توانایی ما خارج است. به عنوان مثال ، در مورد قطرهای به اندازه 0،1 میلیمتر که با سرعت 10سانتیمتر بر ثانیه حرکت میکند، طول موج دوبروی در حدود λ=1.6x10^-22 سانتیمتر خواهد بود. بنابراین ، در مورد الکترون نباید انتظار داشته باشیم که در ابعاد ماکروسکوپی بتوانیم آثار پراش را مشاهده کنیم، به همین علت از ساختار بلوری که فاصله یونها قابل مقایسه با طول موج دوبروی منسوب به الکترون است، استفاده میکنیم.
کلمات کلیدی: هسته ای، فیزیک حالت جامد، اپتیک
تا چندی پیش دو اصل کلی و مستقل از یکدیگر پایه دانش جدید را تشکیل میداد: یکی اصل بقای جرم بود و دیگری اصل بقای انرژی در نیمه دوم قرن هجدهم میلادی لاوازیه دانشمند فرانسوی پس از یک سلسله تجربیات دریافت که مقدار جرم مادی که در فعل و انفعالات شیمیائی دخالت دارند همواره ثابت میماند و این مشخصه مواد را در قانون زیر به نام قانون بقای جرم خلاصه نمود.
هیچ جرمی معدوم نمیشود و هیچ جرمی نیز از عدم بوجود نمیآید و یا به عبارت دیگر مقدار جرم مادی که در عالم وجود دارد همواره ثابت است اصل بقای انرژی میگوید؛ انرژی هر دستگاه معین مقدار ثابتی دارد، نمیتوان انرژی را خلق کرد و نه آنرا از بین برد، فقط اقسام آن میتوانند به یکدیگر تغییر شکل دهند.
|
همزمان جرم آن نیز کاهش مییابد. |
در اوایل قرن بیستم یعنی در سال 1905 نظریه نسبیت (Theory of Relativity) آلبرت انیشتین خدشهای به دو اصل فوق الذکر وارد ساخت زیرا یکی از نظریات نسبیت این است که جرم و انرژی مانند بخار آب و آب که دو شکل مختلف از یک ماده هستند یک چیز واحد بوده و قابل تبدیل به یکدیگر میباشند. بنابراین مقدار جرم مادی را که در عالم وجود دارد نمیتوان ثابت دانست، بلکه از تطبیق نظریه نسبیت با اصل بقای جرم و اصل بقای انرژی میتوان قانون کلی تری نتیجه گرفت که مطابق آن:
" مجموع جرم مادی و مقدار انرژی که در عالم وجود دارد همواره ثابت است."به عقیده آلبرت انیشتین مقدار E که معرف انرژی است و از کلمه لاتین Energy اقتباس شده است، یعنی انرژی هم ارز با جرم m بوسیله رابطه زیر بیان میگردد E = m c2 که در آن E انرژی و m جرم و C سرعت نور در خلا میباشند.
باید بدانید که رابطه E = m c2 چگونگی تبدیل یک کیلو گرم آب به انرژی را بیان نمیکند بلکه فقط اصلی است که هم ارزی جرم و انرژی را بیان میکند، نه اینکه جزئیات نحوه تبدیل آنها را آشکار سازد. رابطه اخیر ایجاب میکند که برای انرژی نیز جرمی قائل شویم . انرژی گرمایی که ضمن احتراق بدست میآید دارای جرم است، ولی این جرم به اندازهای کوچک است که حتی با دقیقترین ترازوها نمیتوان آنرا سنجید مثلا چند نانوگرم (بیلیونوم گرم) در مورد احتراق 12 گرم ذغال. اگر بوسیله حرارت یک تن آب صفر درجه را به 100 درجه برسانیم یعنی به آن 100 میلیون کالری انرژی بدهیم جرم آن فقط 0.004 میلیگرم اضافه میشود.
کلمات کلیدی: هسته ای
مفاهیم پایه
در فیزیک یک اصل کلی هست که میگوید برای متلاشی کردن یک سیستم یا مجموعه پایدار باید کار انجام داد، مثلا اگر سیستم از نوترونها و پروتونها که هسته اتم را ایجاد میکنند پایدار باشد، برای از هم سوا کردن آنها باید انرژی مصرف نمود. بر طبق قانون هم ارزی جرم و انرژی : جرم کلی یک هسته پایدار باید کمتر از مجموع جرمهای جداگانه نوترونها و پروتونهای تشکیل دهنده آن باشد و این اختلاف جرم باید معادل انرژی باشد که جهت متلاشی کردن کامل هسته لازم است، این انرژی موسوم به انرژی همبستگی اتم میباشد.
اکنون مقدار جرم نوترون و پروتون بر حسب گرم و همچنین بر حسب واحد جرم اتمی به دقت معلوم شده است، بنابرا ین چنین به نظر میرسد که هر گاه عدد جرمی و عدد اتمی عنصری معلوم باشد، میتوانیم جرم اتمی آنرا به کمک فرمول زیر حساب نماییم:
در این فرمول M جرم اتمی عنصری است که Z عدد اتمی و A عدد جرمی آن است و مقادیر 1.0076 و 1.0089 نیز به ترتیب جرم پروتون و نوترون بر حسب واحد جرم اتمی (amu) هستند. هنگامی که وجود عناصر ایزوتوپ به تحقق پیوست و توانستند ایزوتوپهای مختلف را مستقیما و دقیقا اندازه بگیرند، دریافتند که همیشه مقدار جرمی که از اندازه گیری عملی بدست میآید کمتر از مقداری است که از طریق محاسبه نتیجه میشود.
بنابراین باید قبول کرد که در هر اتم یک نقص جرمی (Mass Defect) وجود دارد، یعنی مقداری از جرم پروتونها و نوترونهایی که هسته آنرا تشکیل میدهند، در ضمن تشکیل هسته از بین رفتهاند. بنا بر نظریه نسبت ، نقص جرمی هر اتم در ضمن تشکیل هسته آن به انرزی تبدیل میگردد و مقدار این انرژی مساوی است با:
هسته اتم هلیوم از دو عدد پروتون و دو عدد نوترون تشکیل شده است، بنابراین جرم اتمی آن باید مساوی باشد با: 4.033 = 1.0089×2 + 1.0076×2 ، ولی اندازه گیریهای بسیار دقیق جرم اتمی هلیوم را 4.0028 نشان میدهد. بنابراین در ضمن تشکیل هسته هلیوم باید معادل 0.0302 واحد جرم اتمی به انرژی تبدیل شده باشد مقدار این انرزی بر حسب ارگ برای هر اتم گرم مساوی است با:
هرگاه این انرزی را بر حسب الکترون ولت حساب نماییم، مقدار E = 28 MeV را بدست میآوریم که انرزی فوق العادهای است. همچنین برای متلاشی ساختن یک هسته هلیوم به دو پروتون و دو نوترون باید این مقدار انرزی مصرف نمود. چنانکه میبینیم هسته اتم هلیوم بسیار پایدار است و بدین دلیل آنرا در آزمایشگاههای هستهای برای بمباران کردن و متلاشی ساختن هستههای دیگر بکار میبرند.
هرگاه انرزی همبستگی هسته عناصر مختلف را در نظر بگیریم ، میبینیم که مقدار آن تقریبا متناسب با عدد جرمی تغییر میکند، فقط در اتمهای سبک مقدار نسبی این انرژی برای عناصری که عدد جرمی آنها مضرب عدد 4 است (یعنی جرم هسته هلیوم) اندکی بیشتر است. هسته این عناصر از ذره آلفا تشکیل شده و بسیار پایدار است، هر گاه مقدار انرژی همبستگی هر هسته را بر عدد جرمیاش تقسیم نماییم عددی بدست میآید که معرف پایدار بودن هسته مربوطه است و هر چه این عدد بزرگتر باشد هسته پایدارتر است.
دیاگرامهای انرژی همبستگی هستهها نشان میدهد که عناصری با عدد جرمی متوسط انرژی همبستگی نسبی بیشتر دارند و از سایر عناصر پایدارترند (هستههایی که عدد جرمی آنها بین 40 و 100 میباشد). در واکنشهای هستهای هر واکنشی که انرژی همبستگی نسبی آن بیشتر باشد دارای مولد انرژی بیشتری خواهد بود.
هرگاه اتمهای سبک در هم بیامیزند و اتم متوسط تشکیل دهند (تشکیل اتم هلیوم بوسیله 4 تا اتم هیدروژن) و همچنین در صورتی که یک هسته سنگین به دو هسته متوسط تقسیم شود، انرژی بدست خواهد آمد. پیلهای اتمی که در آنها از اورانیوم استفاده میشود از این نوع میباشد. بهتر است بدانید بخاطر اینکه انرژی اتمی در داخل اتمها در حد داخل هستههای اتمی وجود دارد (بخاطر برد کوتاه نیروهای هستهای) به زبان علمی نام انرژی هستهای به آنها اطلاق میشود که از تجزیه مواد رادیو اکتیو طبیعی مقادیر بسیار مهمی از این انرژی تولید میشود.
کلمات کلیدی: هسته ای
مفاهیم ساختار اتمی و هستهای این است که اتم مرکب از هسته و الکترونهایی است که آن را احاطه کردهاند و اینکه هسته از پروتون و نوترون ساخته شده است به این پرسش اساسی میانجامد که: آیا جرم یک اتم خنثی با مجموع جرمهای پروتونها ، نوترونها و الکترونهایی که آن اتم خنثی را تشکیل میدهند. برابر است یا نه؟ این پرسش را به دقت میتوان پاسخ داد. زیرا جرم پروتون ، نوترون و الکترون و همچنین جرمهای تقریبا تمام اتمهای گوناگون معلوم هستند.
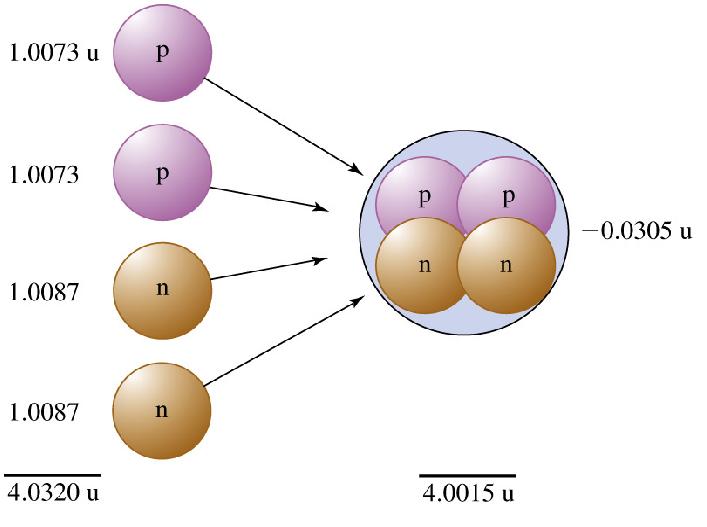 |
در فیزیک یک اصل کلی است که میگوید: برای متلاشی کردن یک سیستم یا مجموعه پایدار باید کار انجام داد. مثلا اگر سیستمی از نوترونها و پروتونها ، که هسته اتم را ایجاد میکنند، پایدار باشد. برای از هم سوا کردن آنها باید انرژی مصرف نمود. جرم کلی یک هسته پایدار باید کمتر از مجموع جرمهای جداگانه نوترونها و پروتونهای تشکیل دهنده آن باشد. از طریق محاسبه و تجربه معین شده است که اختلافی بین مجموع جرم نوکلئونهای هسته و جرم هسته پایدار وجود دارد. این اختلاف جرم معادل انرژی هست که جهت متلاشی کردن کامل هسته لازم است. این انرژی موسوم به انرژی همبستگی اتم میباشد.
بررسی جرمهای اتمی شناخته شده نشان میدهد که برای هر نوع اتم ، جرم اتمی همواره کمتر از مجموع جرمهای ذرات تشکیل دهنده به حالت آزاد آنهاست. سادهترین اتم که دست کم شامل یک پروتون ، یک نوترون و یک الکترون باشد دوتریم است. در این مورد جرمها عبارتند از:
|
در این واکنش هیچگونه اجزای ذرهای که انرژی جنبشی زیادی داشته باشند، ایجاد نمیشود. بنابراین جرمی برابر amu 0.002388 که تفاوت سبکتر شدن 21H از 10n + 11H است، بوسیله اشعه گاما ربوده میشود. انرژی این اشعه از طریق آزمایش معین و معلوم شده که MeV 22.2 یعنی درست همان مقدار پیشگویی شده است.
واکنش معکوس ، یعنی واکنشی که در آن دوتریم با اشعه گاما بمباران میشود، نیز بررسی شدهاست:
به دنبال گیر اندازی یک نوترون بوسیله 11H ، انرژی در یک اشعه گاما آزاد میشود. این انرژی (MeV 22.2) انرژی اتصال دوترون نامیده میشود. این انرژی را میتوان انرژی دانست که وقتی یک پروتون و یک نوترون برای ایجاد یک هسته باهم ترکیب میشود، آزاد میگردد. برای حصول واکنش معکوس (وقتی21H با اشعه ایکس بمباران میشود) انرژی باید جذب شود.
مفهوم انرژی هستهای برای تمام مواردی که اجزایی ساده بوسیله نیرویی به هم میپیوندند و یک سیستم پیچیده بوجود میآورند، بکار میآید. مثلا زمین در مداری به دور خورشید قرار گرفته و با جاذبه گرانشی به آن متصل است و در این صورت برای جدا شدن و گریز از خورشید باید مقداری انرژی جنبشی اضافی به آن داده شود.
در یک اتم هیدروژن eV 13 لازم است تا الکترون از قید هستهای که با جاذبه الکتریکی به آن اتصال یافته خلاص شود. برعکس ، وقتی یک هسته عریان11H الکترونی را گیر میاندازد و به یک اتم هیدروژن خنثای پایدار معمولی مبدل میشود. سیستم مقداری انرژی برابر با eV 13 بوسیله تابش از دست میدهد و این درست انرژی فوتون گسیل یافتهای است که در این فرآیند یعنی ، فرآیند گیراندازی الکترون ، مشاهده میشود. اما فقط انرژیهای اتصال هستهای آنقدر بزرگ هستند که تفاوت جرم مربوط به آنها قابل اندازهگیری میشود.
کلمات کلیدی: هسته ای