| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اورانیوم یکی از عناصر شیمیایی جدول تناوبی است که نماد آن U وعدد اتمِی آن 92 می باشد. اورانیوم که یک عنصر سنگین، سمی، فلزی، رادیواکتیو و براق به رنگ سفید مایل به نقره ای می باشد به گروه آستیندها تعلق داشته و ایزوتوپ 235 آن برای سوخت راکتورهای هسته ای وسلاحهای هسته ای استفاده میشود. معمولا اورانیوم در مقادیر بسیار ناچیز درسخره ها خاک آب گیاهانو جانوران از جمله انسان یافت می شود.
اورانیوم هنگام عمل پالایش به رنگ سفید مایل به نقره ای فلزی با خاصیت رادیو اکتیوی ضعیف یباشد که کمی از فولادنرم تر است. این فلز چکش خاررسانای جریان الکتریسیته و کمی Paramagnetic میباشد. چگالی اورانیوم 65% بیشتر از چگالی سرب میباشد. اگر اورانیوم به خوبی جدا شود بشدت از آب سرد متاثر شده و در برابر هوا اکسید میشود. اورانیوم استخراج شده از معادن میتواند به صورت شیمیایی به دی اکسید اورانیوم و دیگر گونه های قابل استفاده در صنعت تبدیل شود.
اورانیوم در صنعت سه گونه دارد:
دو ایزوتوپ مهم ان U235 و U238 میباشند که u235 مهمترین برای راکتورهای و سلاحهای هسته ای است. چرا که این ایزوتوپ تنها ایزوتوپی است که طبیعت وجود دارد و در هر مقدار ممکن توسط نوترونهای حرارتی شکافته میشود. ایزوتوپ u238 نیز از این جهت مهم است که نوترونها را برای تولید ایزوتوپ رادیو اکتیو جذب کرده و آن را به ایزوتوپ Pu239 پلوتونیوم تجزیه میکند. ایزوتوپ مصنوعی U233 نیز شکافته شده و توسط بمباران نوترونی Thorium232 بوجود میآید.
اورانیوم اولین عنصر یافته شده بود که میتوانست شکافته شود. برای نمونه با بمباران آرام نوترونی ایزوتوپ U235 آن به ایزوتوپ کوتاه عمر U236 تبدیل شده و بلا فاصله به به دو هسته کوچکتر تقسیم میشود که این عمل انرژی آزاد کرده و نوترونهای بیشتری تولید میکند. اگر این نوترونها توسط هسته u235 دیگری جذب شوند عملکرد حلقه هسته ای دوباره اتفاق می افتد و اگر چیزی برای جذب نوترونها وجود نداشته باشد به حالت انفجاری در می آیند. اولین بمب اتمی با این اصل جواب داد «شکاف هسته ای) نام دقیقتر برای این بمبها و بمب های هیدروژنی«آمیزش هسته ای) سلاحهای هسته ای میباشد.
فلز اورانیوم بسیار سنگین و پرچگالی میباشد.اورانیوم خالی توسط بعضی از ارتشها برای ساخت محافظ برای تانکها و ساخت قسمتهایی از موشکها و ادوات جنگی استفاده میشود. ارتشها همچنین از اورانیوم غنی شده برای سوخت ناوگان خود و زیردریایی ها و همچنین سلاحهای هسته ای استفاده میکند. سوخت استفاده شده در راکتورهای ناوگان ایالات متحده معمولا اورانیوم U235 غنی شده میباشد. اورانیوم موجود در سلاحهای هسته ای بشدت غنی میشوند که این مقدار بصورت تقریبی 90% میباشد.
مهمترین کاربرد اورانیوم در بخش غیر نظامی تامین سوخت دستگاههای تولید نیروی هسته ای است که در آنها سوخت U235 به میزان 2الی3% غنی میشود. اورانیوم تخلیه شده در هلیکوپترها و هواپیماها به عنوان وزن متقابل بر هر بار استفاده میشود.
دیگر کاربردهای این عنصر عبارتند از :
 |
|
|
استفاده از اورانیوم به شکل اکسیدطبیعی آن به سال 79 میلادی بر می گردد یعنی زمانی که این عنصر برای اضافه کردن رنگ زرد به سفال لعابدار استفاده شد (شیشه زرد با یک در صد اورانیوم در نزدیکی ناپل ایتالیا کشف شده است.)
کشف این عنصر به شیمیدان آلمانی به نام مارتین هنریچ کلاپرس اختصاص داده شد که در سال 1789 اورانیوم را به صورت قسمتی از کانی که آن را pitchblende نامید کشف شد. نام این عنصر را بر اساس سیاره اورانوس که هشت سال قبل از آن کشف شده بود برگزیده شد .این عنصر در سال 1841 به صورت فلز جداگانه توسط eugne melchior peligot استفاده شد.
در سال 1896 Henri Becquerel فیزیکدان فرانسوی برای اولین بار به خاصیت رادیو اکتیویته آن پی برد.
در پروژه Manhattan نامهای Tuballoy و Oralloy برای اورانیوم طبیعی و اورانیوم غنی شده بکار برده شد. این اسامی هنوز نیز برای اورانیوم غنی شده و اورانیوم طبیعی بکار برده میشوند.
در آغاز قرن بیستم تفحص و جستجو برای یافتن معادن رادیو اکتیو در ایالات متحده آغاز شد. منابع رادیوم که حاوی کانی های اورانیوم نیز می بودند برای استفاده آنها در رنگ ساعت های شب نما و دیگر ابزار جستجو شدند. در طی جنگ جهانی دوم اورانیوم از نظر اهداف دفاعی اهمیت پیدا کرد. در سال 1943 Union Mines Development Corporation کنگره ای را در کلرادو به منظور استفاده ارتش از قدرت اتمی در پروژه Manhattan تشکیل داد.
برای اطمینان از ذخایر کافی اورانیوم این کنگره US Atomic Enecry Act of 1946 را ایجاد و کمیسیون انرژی اتمی را بوجود آورد. در دهه 1960 ملزومات ارتش تزلزل یافت و در اواخر سال 1970دولت برنامه تهیه اورانیوم خود را کامل کرد. همزمان با همین مساله بازار دیگری بوجود آمد که درواقع همان کارخانه های نیروگاه های هسته ای اقتصادی بود.
تترا فلوروئید اورانیوم UF4که به نمک سبز معروف است یک محصول میانی هگزافلورید اورانیوم میباشد. هگزا فلورید اورانیوم UF6 جامد است که در دمای بالای 56 درجه سانتیگراد بخار میشود. UF6 ترکیب اورانیوم است که برای دو فرایند غنی سازی Gaseous Diffusion و Centrifuge استفاده میشود. و در صنعت با نام ساده Hex خوانده میشود.
Yellowcake اورانیوم غلیظ شده است. نام این عنصر بدلیل رنگ و شکل آن در هنگام تولید میباشد اگرچه تولید امروزه Yellowcake بیشتر به رنگ سبز مایل به سیاه میگراید تا زرد. Yellowcake تقریبا 70 تا 90 درصد اکسید اورانیوم دارد. U3O8
Diuranate آمونیوم محصول جنبی تولید Yellowcake میباشد که رنگ آن زرد درخشان میباشد. که گاهی اوقات باعث اشتباه شده و Yellowcake نامیده میشود اما این نام درست این محصول نمیباشد.
 |
اورانیوم عنصر طبیعی است که تقریبا در تمام سنگها آب و خاک به میزان کم یافت میشود. و بنظر می رسد که مقدار آن از Antimony، برلیوم، کادیوم، جیوه، طلا، نقره و تنگستن بیشتر باشد و این فراوانی در حد آرسنیک و مولیبدنیوم است. این عنصر در بیشترکانی های اورانیومی از قبیل Pitchblende،Uraninite ،Autunite,، Uranophane, tobernite و Coffinite یافت میشود.
مقدار بیشتری از اورانیوم در موادی از قبیل صخره های فسفاتی و کانیهای مانند Lignite و Monazite یافت میشود. که بیشتر برای مصارف اقتصادی از همین منابع استخراج می شود. از آنجا که اورانیوم نیمه عمر رادیو اکتیوی طولانی 4.47x109 سال برای U-238 دارد مقدار آن همیشه در زمین ثابت میماند.
بنظر میرسد که فرو پاشی اورانیوم و واکنشهای هسته ای آن با توریوم همان منبع گرمایی عظیمی است که در هسته زمین، باعث ذوب شدن قسمت خارجی هسته زمین گردیده و باعث ایجاد حرکت پوسته ای زمین می شود.
معدن اورانیوم صخره ای است که تمرکزهای اورانیومی میباشد که مقدار اقتصادی ان یک تا چهار پوند اکسید اورانیوم در هر تن میباشد که تقریبا 0.05 تا 0.20 درصد اکسید اورانیوم دارد.
اورانیوم اقتصادی از طریق تقلیل هالیدهای اورانیوم با خاک فلزات قلیایی تولید می شود. همچنین فلز اورانیوم می تواند از طریق عمل الکترولیز 5KUF یا Uf4 که در CaCl2 و NaCl حل شده است بدست آید. اورانیوم خالص نیز از طریق تجزیه حرارتی هالیدهای اورانیوم حاصل میشود.
در سال 2001 مالکان راکتورهای هسته ای غیر نظامی آمریکا از این کشور و منابع خارجی 21300 تن اورانیوم خریداری کردند. قیمت پرداخت شده برای هر کیلوگرم اورانیوم حدودا 26.39 دلار بود که در مقایسه با سال 1998 16% کاهش داشت. در سال 2001 ایالات متحده 1018 تن اورانیوم از 7 عملیات معدنی در غرب رود میسیسیپی تولید کرد.
اورانیوم بیشتر توسط فرانسوی ها در کشورهای جهان توزیع شده است.
 |
معمولا کشورهای بزرگتر اورانیوم بیشتری در مقایسه با کشورهای کوچکتر تولید میکنند. چراکه گسترش و توزیع اورانیوم در جهان یک شکل و یکنواخت است. کشور استرالیا ذخایر بسیار زیادی از این عنصر دارد که تقریبا 30% ذخایر دنیا را شامل میشود.
اورانیوم طبیعی از 3 ایزوتوپ U-238, U-235, U-234 تشکیل شده است که U-238 فراوان ترین آنها (99.3%) میباشد. این سه ایزوتوپ رادیو اکتیو بوده که نیمه عمر آنها عبارت است از U-235 4.5x109 سال که پایدارترین آنها میباشد. U-235 7x108 سال و U234 2.5x105 سال.
ایزوتوپهای اورانیوم میتوانند از هم جدا شوند تا تمرکز یک ایزوتوپ بر دیگری را افزایش دهند. این فرایند "غنی سازی" نام دارد. وزن U-235 برای غنی شدن باید 0.711 درصد افزایش یابد. اورانیوم م235 برای استفاده در سلاحهای هسته ای و نیروگاه های اتمی مناسب تر است . این فرایند مقادیر بسیاری اورانیوم بوجود می آورد که در U-235 تخلیه میشوند و خالصترین اورانیوم یعنی U238 اورانیوم خالی یا DU نام دارد. اگر ایزوتوپ 235 بخواهد تخلیه شود باید وزنش 0.711 درصد کم شود.
تمام ترکیبات اورانیوم سمی و رادیو اکتیو هستند. سمی بودن این عنصر میتواند کشنده باشد. در مقادیر بسیار کم خاصیت سمی بودن این عنصر به کلیه آسیب میرساند. خواص رادیو اکتیوی این عنصر نیز سیستماتیک و نظام بند است. در کل ترکیبات اورانیوم به سختی جذب روده و ریه میشوند و خطرات رادیولوژیکی آن باقی میماند. فلز خالص اورانیوم نیز خطر آتش سوزی به همراه دارد.
فرد ممکن است با تنفس غبار اورانیو م در هوا یا خوردن و آشامیدن آب و غذا در معرض این عنصر قرار بگیرد. البته بیشتر این عمل از طریق خوردن آب و غذا صورت میگیرد. جذب روزانه اورانیوم در غذا 0.07 تا 1.1 میکروگرم میباشد. مقدار اورانیوم در هوا معمولا بسیار ناچیز است. افرادی که در کنار تاسیسات هسته ای دولت و یا معادن استخراج اورانیوم زندگی میکنند بیشتر در معرض این عنصر قرار می گیرند.
اورانیوم ممکن است که درطریق تنفس یا بلع و یا در موارد استثنایی از طریق شکافی روی پوست وارد بدن شود. اورانیوم توسط پوست جذب نمیشود و ذرات آلفای ساتع شده از این عنصر نمیتواند به پوست نفوذ کند. بنابر این اورانیومی که خارج از بدن باشد نمیتواند به اندازه اورانیوم داخل بدن مضر و خطرناک باشد. اگر اورانیوم به بدن وارد شود ممکن است موجب سرطان شده یا به کلیه ها آسیب برساند.
سایتهای خارجی:
کلمات کلیدی: هسته ای
آنچه خداوند در طبیعت به ودیعه نهاده است، اگر بصورت صحیح و در جهت درست مورد استفاده قرار گیرد، وسایل رفاه و آسایش بیشتر را تأمین خواهد کرد. اما اگر این امکانات خدادادی در جهت نادرست و نامشروع مورد بهره برداری قرار گیرند، نه تنها وسیلهای برای آرامش و آسایش او نخواهد بود، بلکه بلای جان او شده و وسیلهای برای تهدید هستی او تبدیل خواهد شد. یکی از این منابع طبیعی سنگ معدن اورانیوم است که اگر بصورت درست مورد استفاده قرار گیرد، بسیار مفید بوده و به تعداد فوقالعادهای میتواند انرژی برق مورد استفاده بشر را تأمین کند، اما متأسفانه استفادههای نادرست سبب شده است که این عنصر خدادادی ماده اولیه سلاحهای مرگبار باشد که بمب اتمی یکی از این نمونهها میباشد.
استفاده از انرژی هستهای به مقیاس زیاد بین سالهای 1939 تا 1945 میلادی در ایالات متحده آمریکا انجام شد. این امر زیر فشار جنگ جهانی دوم ، بصورت نتیجه تلاشهای مشترک تعداد زیادی از دانشمندان و مهندسان صورت گرفت. دست اندرکارانی که در ایالات متحده به این کار اشتغال داشتند، آمریکایی ، بریتانیایی و پناهندگان اروپایی کشورهایی بودند که زیر سلطه فاشیسم قرار داشتند. تلاش آنان این بود که قبل از آلمانیها به یک سلاح هستهای دست پیدا کنند ، این سلاح هستهای همان بمب اتمی بود.
 |
بمب اتمی در اصل یک راکتور هستهای کنترل نشده است که در آن یک واکنش هستهای بسیار وسیع در مدت یک میلیونیم ثانیه در سراسر ماده صورت میگیرد. بنابراین ، این واکنش با راکتور هستهای کنترل شده تفاوت دارد. در راکتور هستهای کنترل شده ، شرایط به گونهای سامان یافته است که انرژی حاصل از شکافت بسیار کندتر و اساسا با سرعت ثابت رها میشود. در این راکتور ، ماده شکافت پذیر به گونهای با مواد دیگر آمیخته میشود که بطور متوسط ، فقط یک نوترون گسیل یافته از عمل شکافت موجب شکافت هسته دیگر میشود، و واکنش زنجیری به این طریق فقط تداوم خود را حفظ میکند. اما در یک بمب اتمی ، ماده شکافتپذیر خالص است، یعنی یک متعادل کننده آمیخته نیست و طراحی آن به گونهای است که تقریبا تمام نوترونهای گسیل یافته از هر شکافت میتواند در هستههای دیگر شکافت ایجاد کند.
بمب اتمی در طول جنگ جهانی دوم از راکتورهای هستهای برای تولید مواد خام نوعی بمب هستهای ، یعنی برای ساختن 239Pu از 235U استفاده میشد. هر دو این عناصر میتوانند یک واکنش زنجیری کنترل نشده سریع ایجاد کنند. بمبهای هستهای یا اتمی از هر دو این مواد ساخته میشوند. تنها یک بمب اتمی که از 235U ساخته شده بود، شهر هیروشیما در ژاپن را در 6 آگوست سال 1945 میلادی ویران کرد. بمب دیگری که از 239U در ساختن آن بکار برده شده بود، سه روز بعد شهر ناکازاکی کشور ژاپن را با خاک یکسان ساخت.
 |
عواقب ناشی از بمب اتمی
یک مسئله فرعی ، ریزشهای رادیواکتیو حاصل از آزمایش بمبهای اتمی است. در انفجار بمب اتمی مقدار قابل توجهی محصولات شکافت رادیواکتیو پراکنده میشوند. این مواد بوسیله باد از یک بخش جهان به نقاط دیگر آن منتقل میشوند و بوسیله باران و برف از جو زمین فرو میریزند. بعضی از این مواد رادیواکتیو طول عمر زیادی دارند، لذا بوسیله مواد غذایی گیاهی جذب شده و بوسیله مردم و حیوانات خورده میشوند. معلوم شده است که اینگونه مواد رادیواکتیو آثار ژنتیکی و همچنین آثار جسمانی زیان آوری دارند. یکی از فراوانترین محصولات حاصل از شکافت 235U یا 239Pu ، که از لحاظ شیمیایی شبیه 4020Ga است. بنابراین وقتی که 90Sr حاصل از ریزشهای رادیواکتیو وارد بدن میشود، به ماده استخوانی بدن راه مییابد. این عنصر میتواند با گسیل ذرات بتا با انرژی 0.54 میلیون الکترون ولت (نیم عمر 28 سال) نابود میشوند، که میتواند به سلولها آسیب رسانده و موجب بروز انواع بیماریها از قبیل تومور استخوان ، لوکمیا و ... ، بخصوص در کودکان در حال رشد ، میشود.
کلمات کلیدی: هسته ای
| اگر نوترون منفردی به یک قطعه ایزوتوپ 235U نفوذ کند، در اثربرخورد به هسته اتم 235U ، اورانیوم به دو قسمت شکسته میشود که اصطلاحا شکافت هستهای نامیده میشود. |

 |
 |
آلایندهها بر حسب ترکیب شیمیاییشان ، به دو گروه آلی و معدنی تقسیم میشوند. ترکیبات آلی حاوی کربن و هیدروژن هستند. برخی از ذرات آلی که بیش از سایر ذرات آلی در اتمسفر یافت میشوند، عبارتند از: فنلها ، اسیدهای آلی و الکلها. معروفترین ذرات معدنی موجود در اتمسفر عبارتند از نیتراتها ، سولفاتها و فلزاتی مانند آهن ، سرب ، روی و وانادیم.
هوا دارای آلایندههای طبیعی نظیر هاگهای قارچها ، تخم گیاهان ، ذرات معلق نمک و دود و ذرات غبار حاصل از آتش جنگلها و فوران آتشفشانهاست. همچنین هوا حاوی گاز منوکسید کربن تولید شده به شکل طبیعی (CO) حاصل از تجزیه متان (CH4) و هیدروکربنها به شکل ترپنهای ناشی از درختان کاج ، سولفید هیدروژن (H2S) و متان (CH4) حاصل از تجزیه بیهوازی مواد آلی میباشد.
منابع آلایندهها را بطور کلی میتوان در چهار گروه اصلی طبقه بندی کرد: شامل وسائط نقلیه موتوری ، وسائط نقلیه هوایی ، ترنها ، کشتیها و هر نوع استفاده و یا تبخیر بنزین ، در بر گیرنده تامین انرژی و حرارت لازم برای مقاصد مسکونی ، تجاری و صنعتی ، نیروگاههای مولد برق که با نیروی بخار کار میکنند، مانند صنایع شیمیایی ، متالوژی ، تولید کاغذ و پالایشگاههای تصفیه نفت ، شامل زایدات ناشی از مصارف خانگی و تجاری ، زایدات زغال سنگ و خاکستر باقیمانده از سوزاندن بقایای کشاورزی.
ترکیبات آلی که تنها دارای هیدروژن و کربن هستند، به نام هیدروکربن نام میگیرند که بطور کلی به دو گروه آلیفاتیک و آروماتیک تقسیم میشوند.
گروه هیدروکربنهای آلیفاتیک شامل آلکانها ، آلکنها و آلکینها هستند. آلکانها عبارتند از: هیدروکربنهای اشباع شده که در واکنشهای فتوشیمیایی اتمسفر نقش ندارند. آلکنها که معمولا به نام اولفینها خوانده میشوند، اشباع نشده هستند و در اتمسفر از لحاظ فتوشیمیایی تا حدودی فعالاند. این گروه در حضور نور خورشید با اکسید نیتروژن در غلظتهای زیاد واکنش نشان میدهند و آلایندههای ثانوی مانند پراکسی استیل نیترات (PAN) و ازن (O3) را بوجود میآورند. هیدروکربنهای آلیفاتیک تولید شده تا حدود (326mg/m3) برای سلامت انسان و جانوران خطرساز نیست.
هیدروکربنهای آروماتیک که از لحاظ بیوشیمیایی و بیولوژیکی فعال و برخی از آنها بالقوه سرطانزا هستند، یا از بنزن مشتق شدهاند و یا به آن مربوط میشوند. افزایش میزان ابتلا به سرطان ریه در نواحی شهری به هیدروکربنهای چند هستهای خارج شده از اگزوز اتومبیلها نسبت داده شده است. بنزوپیرین ، سرطانزاترین هیدروکربنهاست. بنزاسفنانتریلین ، بنزوانتراسین و کریزین هم مواد سرطانزای ضعیفاند.
میللنگها و کاربراتورها ، بیشترین درصد آزادسازی هیدروکربنها را به خود اختصاص دادهاند. تجهیزات سوزاننده مکمل که با کاتالیست کار میکنند، هیدروکربنها را آزاد کرده و منوکسید کربن را سوزانده و تولید CO2 و آب مینمایند.
تکنولوژی کنترل هیدروکربنهای متصاعد شده از منابع ساکن عبارتند از: خاکستر سازی ، جذب ، تراکم و جایگزین نمودن سایر مواد.
فرآیند خاکسترسازی با دستگاههای سوزاننده مکمل و دستگاههای سوزاننده مکمل کاتالیستی صورت میگیرد. جذب سطحی توسط کربن فعال صورت میگیرد و جذب هیدروکربنها بوسیله یک محلول شوینده در برجهای سینیدار ، شویندههای جت و برجهای آکنه ، برجهای پاشنده و شویندههای ونتوری صورت میگیرد.
گاز منوکسید کربن ، بیرنگ ، بیمزه و بیبو است و در شرایط عادی از لحاظ شیمیایی بیاثر و طول عمر متوسط آن در اتمسفر حدود 2.5 ماه است. در حال حاضر مقدار منو اکسید کربن در اتمسفر بر روی اموال انسانی ، گیاهان و اشیا بیاثر یا کماثر است. در غلظتهای زیاد منو کسید کربن ، به علت تمایل زیاد به جذب هموگلوبین میتواند در متابولیسم تنفسی انسان بطور جدی اختلال ایجاد نماید.
غلظت منوکسید کربن در نواحی متراکم شهری که ترافیک سنگین و حرکت خودروها کند است، به میزان قابل توجهی افزایش مییابد. منابع کربن ، منوکسید کربن طبیعی و انسانی هستند. طبق گزارش آزمایشگاه ملی آرگون ، در اثر اکسیداسیون گاز متان حاصل از مرگ گیاهان سالانه 13.2 میلیون تن CO وارد طبیعت میشود. منبع دیگر تولید این ماده ، متابولیسم انسانی است بازدم شخصی که در حال استراحت است بطور تقریبی حاوی CO ، 1ppm است.
آنگاه که مقدار منوکسید کربن در مدت زمان کوتاهی به حد مرگبار میرسد و شرایط اضطراری میشود، برای مقابله با چنین شرایطی که مقدار CO بطور متوسط در مدت زمان 8 ساعت به (46mg/m3 (40ppm میرسد،عملیات شدید کنترلی انجام میشوند که عبارتند از: متوقف ساختن کارخانههای صنعتی و مسدود نمودن جادههایی که در آنها معمولا ترافیک سنیگن وجود دارد. جذب سطحی ، جذب ، میعان و احتراق روشهای فنی کنترل CO هستند.
این اکسیدها شامل 6 ترکیب مختلف گازی هستند: منوکسید سولفور (SO) ، دیاکسید سولفور (SO2) ، تریاکسید سولفور (SO) تترا اکسید سولفور (SO4) ، سکو اکسید سولفور (SO2) و هپتو اکسید سولفور (S2O7). در مطالعه آلودگی هوا ، دیاکسید سولفور و تریاکسید سولفور حائز بیشترین اهمیت است. با توجه به پایداری نسبی SO2 در اتمسفر این کار میتواند به عنوان یک عامل اکسید کننده و یا احیا کننده وارد عمل شود.
SO2 که با سایر اجزای موجود در اتمسفر به شکل فتوشیمیایی یا کاتالیستی وارد واکنش میشود، میتواند قطرات اسید سولفوریک (H2SO4) و نمکهای اسید سولفوریک را تولید بکند. SO2 با آب وارد واکنش شده ، تولید سولفورو اسید مینماید. این اسید ضعیف با بیش از 80% SO2 آزاد شده در اتمسفر ناشی از فعالیتهای انسانی به سوزاندن سوختهای جامد و فسیلی مربوط میشود.
روشهای گسترده جهت کنترل اکسید سولفور عبارتند از: بکارگیری سوختهای دارای گوگرد کمتر ، جداسازی گوگرد از سوخت ، جایگزین ساختن منابع انرژیزای دیگر ، تبدیل زغال سنگ به مایع یا گاز ، پاکسازی محصولات حاصل از احتراق.
شامل منوکسید نیتروژن (NO) ، دیاکسید نیتروژن (NO2) ، نیترو اکسید (N2O) نیتروژن سیسکواکسید (N2O3) ، نیتروژن تترااکسید (N2O4) و نیتروژن پنتواکسید (N2O5) هستند.
دو گاز مهمی در معادلات آلودگی هوا مهماند عبارتند از: اکسید نیتریک (NO) و دیاکسید نیتروژن ، دیاکسید نیتروژن که از هوا سنگینتر و در آب محلول است، در آب تشکیل اسید نیتریک و یا اسید نیترو و یا اکسید نیتریک (NO) میدهد. اسید نیتریک و اسید نیترو در اثر بارندگی به سطح زمین سقوط کرده ، یا با آمونیاک موجود در اتمسفر (NH3) ترکیب شده آمونیم نیترات (NH4NO3) بوجود میآورد.
در این مواقع 2NO از اجزای غذایی گیاهان را تشکیل میدهد. NO2 یکی از اجزای غذایی گیاهان را تشکیل میدهد. NO2 که در دامنه تشعشع فوقبنفش جاذب خوب انرژی به شمار میرود، در تولید آلایندههای ثانوی هوا از قبیل ازن O3 نقش مهمی دارد مقدار NO آزاد شده در اتمسفر به مراتب بیش از مقدار NO2 آزاد شده است. NO در فرآیندهای احتراقی با دمای زیاد و در اثر ترکیب نیتروژن و اکسیژن بوجود میآید.
برخی از اکسیدهای نیتروژن به صورت طبیعی و برخی به صورت انسانی ایجاد میشوند. در اثر آتشسوزی جنگل مقدار اندکی NO2 ایجاد میشود. تجزیه باکتریایی مواد آلی نیز سبب آزاد شدن NO2 در اتمسفر میشود. در واقع منابع تولید کننده NO2 بطور طبیعی تقریبا 10 برابر منابع انسانی که در نواحی شهری دارای تراکم و غلظت هستند میباشد. بخش عمده NO2 تولید شده از منابع انسانی مربوط به احتراق سوخت در منابع ساکن و حرکت وسائط نقلیه میباشد.
بطور کلی اغلب اندازه گیریهای کنترلی برای NO2 آزاد شده در راستای محدود ساختن شرایط احتراق و کاهش تولید NO2 و همچنین استفاده از تجهیزات متنوع برای حذف NO2 از جریان گازهای خروجی انجام میشوند.
اکسید کنندهها یا اکسید کنندههای کامل دو عبارتی هستند که برای توصیف مقادیر اکسید کنندههای فتوشیمیایی بکار میروند و معمولا نشاندهنده قدرت اکسید کنندگی هوای اتمسفر میباشند. ازن (O3) که اکسید کننده فتوشیمیایی اصلی است، در حدود 90 درصد از اکسید کنندهها را بخود اختصاص میدهد. سایر اکسید کنندههای فتوشیمیایی مهم در کنترل آلودگی هوا عبارتند از: اکسیژن نوزاد (O) ، اکسیژن مولکولی برانگیخته (O2) ، پروکسی آسیل نیترات (PAN) ، پروکسی پروپانول نیترات (PPN) ، پروکسی بوتیل نیترات (PBN) ، دی اکسید نیتروژن (NO2) ، پراکسید هیدروژن (H2O2) و الکیل نیتراتها.
اثرات اکسیدکنندهها بر سلامتی انسان میتواند موجب سرفه ، کوتاهی نفس ، گرفتگی راه عبور هوا ، گرفنگی و درد قفسه سینه ، عملکرد نامناسب ششها ، تغییر سلولهای قرمز خون ، آماس خشک و سوزش چشم ، بینی و گلو شوند. اکسید کنندههای اصلی که به گیاهان آسیب میرسانند، عبارتند از PAN , O3 که از خلال روزنههای موجود در برگ وارد گیاه شده و در متابولیسم سلول گیاهی دخالت میکنند. علائم بوجود آمده از تماس گیاه با PAN عبارتند از: برونزه شدن ، براق شدن و نقرهای شده سطح زیرین برگها.
تماس متناوب اکسید کنندهها با گیاهان موجب کاهش محصولات میشود. اکسید کنندهها به سرعت با رنگها ، الاستومرها (اکسید کنندهها) الیاف پارچهای و رنگهای نساجی واکنش نشان داده ، آنها را اکسید میکند.
این نکته روشن شده است که حتی اگر هیچ هیدروکربنی در اتمسفر وجود نداشته باشد، تا زمانی که CO و NO2 حضور دارند، مقادیر قابل ملاحظهای از ازن میتواند تولید شود. در حال حاضر علیرغم کوششهای منظم بر روی کنترل CO ، هیدروکربنها و NO2 مقادیری از این آلایندهها که برای ایجاد ازن فتوشیمیایی کافی هستند، همچنان در اتمسفر وجود دارد.
کلمات کلیدی: هسته ای، هواشناسی و اختر فیزیک
!نگاه اجمالی
حتماً تا کنون درباره DVD یا CD و یا جراحی چشم با لیزر و غیره چیزهایی شنیدهاید و حتما این بزرگترین اختراع علوم را تا کنون به عناوین مختلف استفاده کردهاید؛ بدون آنکه از خودتان سؤال کرده باشید که مخترع لیزر چه کسی بوده است. آیا میدانید که مخترع لیزر یک ایرانی بوده است؟ اولین نوع لیزر ؛ لیزر گازی بود (که در سیستم درمانی و صنایع بطور گسترده بکار برده میشود) که توسط آقای علی جوان متخصص فیزیک اختراع شد.
 |
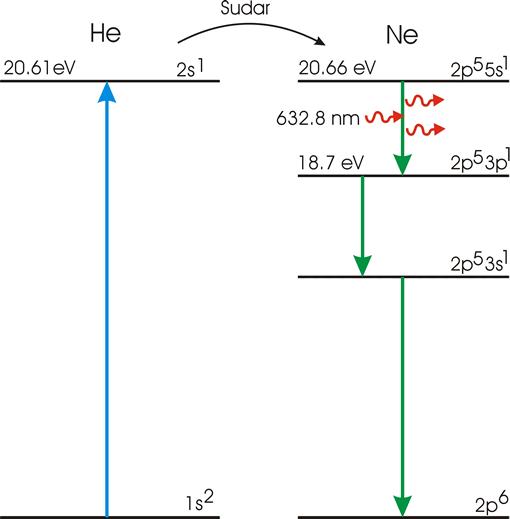
لیزر هلیوم _ نئون اولین لیزری بود که در دسامبر 1960 با خروجی 1.15 میکرومتر بطور پیوسته عمل کرد. عمل برانگیختگی در این لیزر از طریق تخلیه الکتریکی ، در مخلوط از هلیوم و نئون انجام میشد. از آن زمان انواع زیادی از لیزرهای گازی در گستره وسیعی از طول موج از 100 نانومتر فرابنفش خلا تا فروسرخ دور یا حتی امواج میلیمتری ، تولید شدهاند. بیش از 5000 خط لیزری شناسایی شدهاند. در بیشتر موارد گاز بوسیله تخلیه الکتریکی یا دمش اپتیکی ، به یاری ساز و کارها و روشهای متعددی برانگیخته میشود.
در دنیای علمی و علوم ، این مثل همیشه گفته میشود که وقتی که زمان برای یک اختراع یا یک کشف درست شده و شما آنرا انجام ندهید، کس دیگری انجام خواهد داد. این مثل تا حد زیادی حقیقت دارد، اما همیشه اینطور نیست. بعضی وقتها آدمها یک فکر خوب را از دست میدهند. وقتی که نوبت برسد به لیزر ، لیزر گازی ، میتوانست در سال 1930 اختراع شده باشد، نه پس از سی سال در سال 1960 که من آنرا اختراع کردم. اگر شما به تاریخ علم نگاه کرده باشید، مخصوصا به فیزیکدانان اروپایی ، آنها به اختراع لیزر در سالهای 1937 و 1938 خیلی نزدیک شده بودند.
دانشمندان در حال مطالعه بر روی اتمها بودند، که چگونه امواج نوری را بیرون بدهند (تقویت نور در گازها بوسیله گسیل القائی پرتوافکنی) و آنها به اختراع لیزر خیلی نزدیک شده بودند. از نوشتجات آنها شما میتوانید ببینید که آنها به راه درست رفته بودند، اما بعدا راه را اشتباه رفته و از مسیر اصلی منحرف شدند. اگر من در همان سالها بودم مطمعنا آنرا اختراع میکردم، مبالغه نمیکنم و میدانم که آنرا انجام میدادم.
 |
|
مجله "Smithsonian" آوریل 1971. |
من میدانم که این دانشمندان چرا آنرا از دست دادند؛ آنها عمیقا درگیر با داراییهای موضوع در تعادل گرمایی بودند. با این وجود در لیزرها ، اتمها باید در یک حالت تعادل غیر گرمایی باشند؛ که این قدری پیچیده میشود و از حوصله این بحث خارج است. البته تمام آنها اکنون تمام شده است، ولی آن دانشمندان پیشروان این راه بودهاند. موقعی که من نظریهام را در رابطه با لیزر گازی دادم، بعضی از قسمتهای آنرا ، نه تمام آن ، بر اساس گرفتاری من در کارهایی بود که مشغول انجام آن بودم. اما من میدانستم که بالاخره این لیزر گازی را میتوانم اختراع کنم، در غیر اینصورت اصلا دنبال آن کار را نمیگرفتم.
کسانی که از همان ابتدا نظر من را میدانستند، خیلی به آن بدبین بودند. حتی آنهایی که در تیم من بودند و با من کار میکرند، در این رابطه شک داشتند. من این شک را در بسیاری از آنها دیدهام. حتی فیزیکدانان خوب هم بعضی وقتها در عقاید خودشان نامطمئن هستند و آنها با تردید منزلزل میشوند.
استفاده از گازها به عنوان ماده فعال لیزری تفاوت جالبی با جامدات دارد. به دلیل آنکه جمعیت معکوسی که میتوان در گازها بدست آورد، خیلی کمتر از جامدات است، یک میله Nd-YAG تقریبا 6X1025 اتم Nd در مترمکعب دارد، ولی در لیزر He_Ne فقط 1021 اتم Ne در هر مترمکعب وجود دارد. بنابراین انتظار داریم که لیزرهای گازی پرقدرت خیلی حجیم و بزرگ باشند. از سوی دیگر ، گازها بسیار یکنواختتر و همگنتر از جامدات هستند و میتوان برای خنک کردن و دوباره پر کردن آنها را در یک مدار بسته به حرکت در آورد.
 |
برای گازها بطور کلی پهن شدگی ترازهای انرژی نسبتا کوچک است (در مرتبه چند گیگا هرتز یا کمتر) چون ساز و کارهای پهن شدگی خط ضعیفتر از جامدات است، برای گازهایی در فشار پایین (چند تور) که اغلب در لیزرها بکار میروند، پهن شدگی القا شده در اثر برخورد خیلی کوچک است و بنابراین پهناهای خط اساسا با پهن شدگی دوپلری تعیین میشوند. بدین دلیل دمش اپتیکی با لامپهای بکار رفته برای لیزر حالت جامد ، در مورد گازها انجام نمیشود.
این لامپها زیاد کارآیی ندارند، چون طیف گسیلشان کم و بیش پیوسته است. در حالی که در محیط فعال هیچ نوار جذب پهنی وجود ندارد. تنها موردی که عمل لیزر در گاز بوسیله این نوع دمش اپتیکی حاصل شده است، دمش Gs با لامپ حاوی He است. در این مورد وضعیت برای دمش اپتیکی کاملا مناسب است، چون برخی از خطوط گسیل He منطبق بر خطوط جذب Cs هستند، ولی اهمیت این لیزر بیشتر از جنبه تاریخی آن است.
لیزرهای گازی معمولا با ابزارهای الکتریکی برانگیخته میشوند، یعنی دمش با عبور جریان به اندازه کافی قوی (dc یا تپی) از گاز انجام میشود. ساز و کارهای اصلی دمشی که در لیزرهای گازی صورت میگیرد، با عبور جریان الکتریکی مناسبی از گاز حاصل میشود. یونها و الکترونهای آزاد بوجود میآیند و چون این ذرات در اثر میدان الکتریکی شتابدار میشوند، انرژی جنبشی اضافی بدست میآورند و میتوانند با برخورد و به اتمهای خنثی آنها را برانگیخته کنند. دمش الکتریکی گاز معمولا با یکی از دو فرآیند زیر انجام میگیرد:
 |
|
|
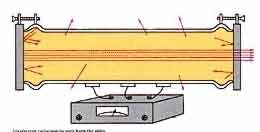
از آنجایی که اتمها خطوط جذبی بسیار باریکی در گازها دارند، تقریبا غیر ممکن است که بتوان به کمک تحریک (دمش) نوری در آنها جمعیت معکوس ایجاد نمود و به جای آن معمولا از روش تخلیه الکتریکی استفاده میشود. یک طرح شماتیک لیزر گازی با فشار کم مانند لیزر هلیوم _ نئون که در آن گاز تحت فشار تقریبا کم ، داخل لوله تخلیه با آند و کاتد در دو طرف آن قرار دارد. اگر آینههای تشدید کننده خارج از لوله تخلیه باشند، پنجرههای بروستر در دو انتهای لوله قرار میگیرند تا اتلاف در اثر بازتاب را کاهش دهند، این عمل البته باعث پلاریزه شدن نور خروجی میشود.
ولتاژ چندین کیلوولت در سرتاسر لوله اعمال میشود تا تخلیه الکتریکی انجام شود. در بعضی موارد گاز ممکن است قبلا کمی یونیزه شود. این عمل به کمک پالس ولتاژ بالا که به یکی از الکترودها اعمال شود و یا یک سیم کوتاهی که به دور لوله پیچیده شود، انجام میگیرد. در این روش تخلیه الکتریکی هم الکترونها و هم یونها و هم اتمهای خنثی وجود دارند. الکترونهای آزاد توسط میدان الکتریکی در تخلیه شتاب میگیرند و به سمت آند حرکت میکنند و اگر در بین راه به اتمها و یونها برخورد کنند، مقداری و یا همه انرژی خود را از دست میدهند و آن را به تراز بالای لیزری دمش میکنند.