* مطالب علمی *
ایساتیس
آقاشیر
.: شهر عشق :.
جملات زیبا
تعقل و تفکر
دکتر رحمت سخنی
بیگانه ، دختری در میان مردمان
تا ریشه هست، جوانه باید زد...
اس ام اس عاشقانه
خاطرات خاشعات
اس ام اس سرکاری اس ام اس خنده دار و اس ام اس طنز
وسوسه عقل
پرهیزکار عاشق است !
فروش و تعمیر موبایل در استان یزد
آموزش
وبلاگ تخصصی کامپیوتر
هک و ترفند
فروش و تعمیر موبایل در استان یزد
انجمن فیزیک پژوهش سرای بشرویه
عاشقان خدا فراری و گریزان به سوی عشق و حق®
وبلاگ عشق و محبت ( اقا افشین)
باید زیست
دست نوشته های دو میوه خوشمزه
در دل نهفته ها
روزگاران(حتما یه سری بهش بزن ضرر نمی کنی)
فقط برای ادد لیستم...سند تو ال
تجربه های مدیریت
سولات تخصصی امتحان دکترا دانشگاه آزاد
سولات تخصصی امتحان دکترا دانشگاه آزاد
ارزانترین و بزرگترین مرکز سوالات آزمون دکترا
عکس و اس ام اس عشقولانه
دانلود نرم افزار های روز دنیا
شاهرخ
مکانیک هوافضا اخترفیزیک
مکانیک ، هوافضا ،اخترفیزیک
وبلاگ تخصصی فیزیک و اختر فیزیک
وبلاگ تخصصی فیزیک جامدات
همه با هم برای از بین نرفتن فرهنگ ایرانی
انتخاب
فیزیک و واقعیت
ترجمه متون کوتاه انگلیسی
دنیای بیکران فیزیک
| گرمای جذب شده بوسیله واکنشی که در فشار ثابت انجام میگیرد برابر با تغییر آنتالپی است. آنتالپی ، همانند انرژی داخلی ، تابعی از حالت سیستم و مستقل از راهی است که به آن حالت میرسد. یعنی تابع حالت و یک کمیت شدتی است. |
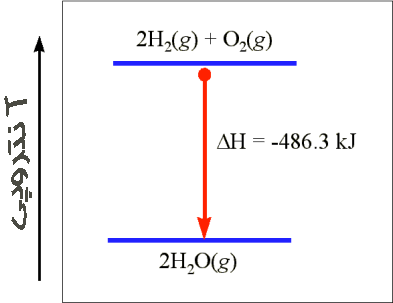
کار در واکنشهای شیمیایی
برای واکنشهای شیمیایی عادی ، کار عموما ناشی از تغییرات فشار ، حجم است. اگر سیستم (به علت گاز) منبسط شود، در برابر فشار اتمسفر کار انجام میدهد واین نمونهای از کار فشار - حجم است. جمله PV دارای ابعاد کار است. فشار که نیرو بر واحد سطح است، بر حسب نیوتن بر متر مربع N/m2 بیان میشود. اگر حجم بر حسب متر مکعب m3 بیان شده باشد، حاصلضرب PV عبارت خواهد بود از:
(PV=(N/m2)(m3)=N.m(J
نیوتن متر (یک ژول) یک واحد کار است، زیرا کار به صورت حاصلضرب نیرو (نیوتن) در فاصله (متر) تعریف شده است. به طریق مشابه میتوان گفت که لیتر اتمسفر نیز واحد کار است. اگر فشار ثابت بماند و حجم بر اثر انبساط از VA به VB برسد، کار انجام شده عبارت خواهد بود از:
W=P(VB-VA)=P∆V
کار انجام شده در حجم ثابت
هیچ گونه کار فشار ، حجمی نمیتواند بوسیله فرآیندی که در حجم ثابت صورت میگیرد، انجام شود، W=0 خواهد بود. پس در حجم ثابت معادله: E=Q-W∆
به صورت زیر در خواهد آمد: E=QV∆ که در آن qv کار انجام شده در حجم ثابت است.
کار انجام شده در فشار ثابت
در شیمی فرآیندهایی که در فشار ثابت انجام میگیرند، بسیار متداولتر از فرآیندهایی هستند که در حجم ثابت انجام میشوند. اگر ما توجه خود را بکار فشار - حجم متمرکز کنیم، کار انجام شده در فرآیندهایی که در فشار ثابت به صورت P∆V خواهد بود. پس در فشار ثابت معادله
: E=q-W∆ به صورت زیر در خواهد آمد:
E=qp+P∆V∆
اگر در معادله فوق qp را به دست آوریم خواهیم داشت:
که در آن ، گرمای جذب شده بوسیله سیستم در فشار ثابت است.
تابع ترمودینامیکی آنتالپی
تابع ترمودینامیکی آنتالپی ، H ، با معادله زیر معادله زیر تعریف میشود: H=E+PV
بنابراین qp=∆H
یعنی گرمای جذب شده بوسیله سسیتم در واکنش در فشار ثابت:
اعتبار قانون هس نیز براساس آنتالپی استوار است.
رابطه بین تغییرات در آنتالپی و تغییر در انرژی درونی
وقتی که برای اندازه گیریهای گرماسنجی، از گرماسنج بمبی استفاده میکنیم، اثر گرمایی در حجم ثابت اندازه گیری میشود. واکنشهای معمولی در فشار ثابت انجام میشوند. رابطه میان تغییر در آنتالپی و تغییر در انرژی داخلی برای تبدیل گرماهای واکنش در حجم ثابت qv=∆E به گرماهای واکنش در فشار ثابت qp=∆E مورد استفاده قرار میگیرد. این تغییر با توجه به تغییر حجم محصولات واکنش به عمل میآید و این تغییر در حجم مایعات و جامدات به قدری است که میتوان ان را نادیده گرفت.
اما در واکنشهایی که مواد گازی دخالت دارند، تغییر حجم اهمیت پیدا میکند فرض کنید که VqA حجم کلی واکنش دهندههایی گازی ، VqB حجم کلی محصولات گازی ، nA عمده مولهای واکنش دهندههای گاز ، np عده مولهای محصولات گازی و فشار و دما ثابت است. در این صورت E+(∆n)RT∆=∆
که در آن n∆ عده مولهای محصولات منهای عده مولهای واکنش دهندههای گازی است.
آنتالپی تشکیل
یک روش آسان برای محاسبه H∆ یک واکنش ، استفاده از مقادیر ثبت شدهای است که آتالپیهای تشکیل استاندارد نامیده میشود. آنتالپی تشکیل استاندارد (که با نماد H˚f∆ نشان داده میشود) مقدار H∆ مربوط به واکنشی است که در آن یک مول ماده در 1atm و دمای مرجع خاصی از عناصر سازنده آن در پایدارترین شکلی که در فشار 1atm و دمای مرجع دارند، تشکیل میشود. نماد ˚H∆ که مشخص کننده تغییرات آنتالپی استاندارد است، برای واکنشهایی بکار میآید که فقط شامل موادی در حالت استاندارد هستند.
کلمات کلیدی: ترمو دینامیک



.GIF)



