| میزان کاتورگی یا بینظمی یک سیستم که به عنوان معیار خودبخودی واکنش بکار میرود، آنتروپی نامیده میشود که برحسب J/K.mol بوده و با S نمایش داده میشود. |
قانون دوم ترمودینامیک و آنتروپی
قانون اول ترمودینامیک به معرفی انرژی درونی ، U ، منجر شد. این کمیت تابع حالتی است که بر مبنای آن ، مجاز بودن یک فرآیند مورد قضاوت قرار میگیرد و بیان میدارد که فقط تحولاتی مجاز است که انرژی داخلی کل سیستم منزوی ، ثابت بماند. قانونی که ملاک خودبخودی بودن را مشخص میسازد (قانون دوم ترمودینامیک) ، برحسب تابع حالت دیگری بیان میشود. این تابع حالت ، آنتروپی ، S ، است.
ملاحظه خواهیم کرد که بر مبنای آنتروپی قضاوت میکنیم که آیا یک حالت بطور خودبخودی از حالت دیگری قابل حصول میباشد. در قانون اول با استفاده از انرژی داخلی ، تحولات مجاز مشخص میشود (آنهایی که انرژی ثابت دارند). از قانون دوم با استفاده از آنتروپی ، تحولات خودبخودی از بین همان فرآیندهایی مشخص میشود که بر مبنای قانون اول مجاز میباشد.
آنتروپی سیستم منزوی در یک فرآیند خودبخودی افزایش مییابد: 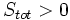
که 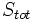 ، آنتروپی تمام قسمتهای سیستم منزوی میباشد.
، آنتروپی تمام قسمتهای سیستم منزوی میباشد.
از آنجایی که فرآیندهای برگشت ناپذیر (مانند سرد شدن شیئی تا دمای محیط و انبساط آزاد گازها) خودبخودی است، در نتیجه همه آنها با افزایش آنتروپی توام میباشند. این نکته را میتوان به این صورت مطرح کرد که در فرایندهای برگشت ناپذیر آنتروپی تولید میشود. از طرف دیگر ، در فرایند برگشت پذیر توازن وجود دارد، یعنی سیستم با محیط در هر مرحله در تعادل است. هر مرحله بسیار کوچک در این مسیر برگشت پذیر بوده و پخش نامنظم انرژی روی نمیدهد و در نتیجه آنتروپی افزایش نمییابد، یعنی در فرآیند برگشت پذیر آنتروپی ایجاد نمیشود. آنتروپی در فرآیندهای برگشت پذیر از بخشی از سیستم منزوی به بخش دیگری منتقل میگردد.
بر مبنای تعریف آماری ، فرض میشود که در واقع میتوانیم با استفاده از فرمول ارائه شده توسط لوودیگ بولتزمن (Ludwing Boltzmann) در سال 1896 ، آنتروپی را محاسبه کنیم: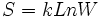
که k، ثابت بولتزمن است: 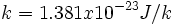
این ثابت به صورت 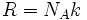 به ثابت گاز ربط دارد. کمیت W تعداد راههای متفاوتی است که سیستم میتواند با توزیع اتمها یا مولکولها بر روی حالتهای در دسترس به انرژی خاصی برسد. واحد آنتروپی با واحد k یکسان است. در نتیجه واحد آنتروپی مولی ،
به ثابت گاز ربط دارد. کمیت W تعداد راههای متفاوتی است که سیستم میتواند با توزیع اتمها یا مولکولها بر روی حالتهای در دسترس به انرژی خاصی برسد. واحد آنتروپی با واحد k یکسان است. در نتیجه واحد آنتروپی مولی ،  میباشد؛ (این با واحد R و ظرفیت گرمایی یکی است.)
میباشد؛ (این با واحد R و ظرفیت گرمایی یکی است.)
در روش ترمودینامیکی ، تمرکز بر روی تغییر آنتروپی در طول یک فرایند ، dS ، میباشد، نه مقدار معلق S. تعریف dS بر این مبناست که میتوان میزان پخش انرژی را به انرژی مبادله شده به صورت گرما ، در حین انجام فرایند ربط داد. تعاریف آماری و ترمودینامیکی با هم سازگار میباشند. در شیمی فیزیک این یک لحظه نشاط آور است که بین خواص تودهای (که مورد نظر ترمودینامیک است) و خواص اتمها یک ارتباط برقرار شود.
تغییر آنتروپی محیط
تغییر آنتروپی محیط را با علامت "dS نشان میدهیم. علامت پریم مربوط به محیط سیستم واقعی که در سیستم منزوی بزرگ قرار دارد، مربوط میشود. محیط را با یک مخزن حرارتی بزرگ (عملا یک حمام آب) نشان میدهیم که در دمای T باقی میماند. مقدار گرمای منتقل شده به مخزن در اثر انجام کار مانند سقوط یک وزنه را با "dq نشان میدهیم که این گرما به مخزن منتقل میشود. هرچه مقدار گرمای بیشتری به مخزن منتقل شود، حرکت حرارتی بیشتری هم در آن ایجاد میشود و از این رو ، پخش انرژی به میزان بیشتری اتفاق میافتد. از این نکته استنباط میشود که:
اگر گرما به مخزن سردی منتقل شود، کیفیت انرژی نسبت به موردی که آن گرما به مخزن گرمتری داده شود، انحطاط بیشتری خواهد داشت. در مورد اخیر میتوانیم در اثر جاری شدن گرمای "dq از یک مخزن سرد به مخزن سردتری کار استخراج کنیم، اما اگر این گرما مستقما به مخزن سردتر منتقل شود، استخراج چنین کاری امکان پذیر نیست.
نتیجه میگیریم که اگر مقدار معین انرژی به صورت گرما به مخزن گرمی داده شود، آنتروپی کمتری ایجاد میشود تا اینکه آن انرژی به مخزن سردی داده شود. سادهترین راهی که میتوان این وابستگی دمایی را به حساب آورد، چنین است: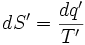
که "T دمایی است که در آن دما ، انتقال گرما صورت گرفته است. برای یک تغییر قابل اندازه گیری در دمای ثابت چنین داریم:
وقتی که مقدار زیادی حرکت حرارتی در دمای پایین ایجاد شود، تغییر آنتروپی بزرگی اتفاق میافتد. برای فرآیند آدیاباتیک:
0 = "q وقتی 0 = "S∆
این نتیجه برای هر فرآیندی ، برگشت پذیر یا برگشت ناپذیر ، صحیح است، تا زمانی که مناطق گرم محلی در محیط ایجاد نشود، یعنی زمانی این نتیجه صحیح است که محیط ، تعادل درونی خود را حفظ کند. اگر مناطقی محلی بوجود آید، انرژی از این مناطق بطور خودبخودی پخش میشود و در نتیجه آن آنتروپی تولید میشود. موقعی که یک واکنش شیمیایی با تغییر آنتالپی H∆ در سیستمی انجام میشود، گرمایی که در فشار ثابت وارد محیط میشود، برابر با 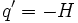 . بنابراین تغییر آنتروپی محیط برابر است با:
. بنابراین تغییر آنتروپی محیط برابر است با:
کلمات کلیدی: ترمو دینامیک